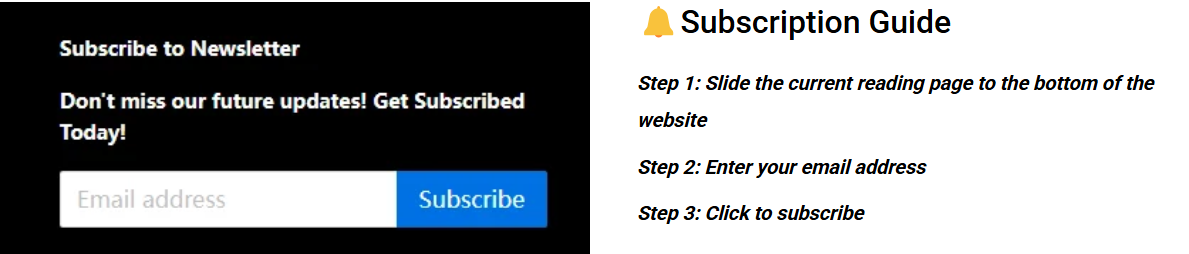
医療機器プロトタイプの核となる使命である規制遵守の確保は、一般的なエンジニアリングプロトタイプとは根本的に異なります。実際、これが反復開発の遅さに関する誤解の根本原因です。従来のモデルでは、機能検証と規制検証が分離されているため、生体適合性や電気安全性といった規制上の課題に直面した場合、後になってプロトタイプに大幅な変更を加える必要があり、臨床試験や登録が大幅に遅れることになります。
LS Manufacturingの「登録志向プロトタイピング」戦略は、設計段階から体系的に規制要件を組み込むものです。この戦略では、プロトタイプの機能実現と並行して、主要な登録要素を確実に満たすために規格を最優先事項としています。これにより、プロトタイプは臨床検証および登録試験の要件を満たし、製品発売の初回成功を保証します。お客様の時間を節約するために、主要な調査結果の概要を以下に示します。
医療機器プロトタイピングクイックリファレンス
| モジュール | 重要なポイント |
| コアコンセプト | 規制遵守の機能を組み込んだ「登録向けプロトタイプ」を作成します。 |
| 従来の問題点 | プロセスの後半で規制要件が導入されると、プロトタイプが繰り返し修正されることになり、市場投入までの時間が遅れることになります。 |
| 重要な要素 | 生体適合性、ユーザビリティエンジニアリング、リスク管理はすべてプロトタイピング段階で一緒に対処する必要があります。 |
| 解決 | 積極的な規制監視と並行作業を通じて、最初から適切な設計を実現します。 |
| 究極の価値 | 登録のリスクを大幅に削減し、製品の発売サイクル全体を大幅に短縮します。 |
次の表は、規制要件を変更することで医療機器の開発を加速する方法を示しています。 「後期段階のハードル」から「初期段階の設計インプット」へ。 「登録重視」のアプローチへの移行は、プロトタイプ自体が登録の基礎となり、後々の混乱を招くような変更を加えることなく、効率的で信頼性が高く迅速な市場投入を目指すことを意味します。
このガイドを信頼する理由:LS製造の専門家による実践的な経験
医療機器のプロトタイピングに関する記事はオンラインで数千件も存在します。では、なぜこの記事を読む時間が必要なのでしょうか?ここでご紹介するのは、教科書的な定義ではなく、 ISO 13485およびISO9001システムの厳格な制約に基づき、数え切れないほどの手術や試験結果を通して検証された実践的なガイドラインです。
10年以上にわたり、私たちのチームは医療機器向けISO 13485品質システム要件を満たす5万個以上のカスタムプロトタイプを製造してきました。それぞれのプロジェクトを通じて、生分解性マグネシウム合金の切削パラメータを熱損傷なく設定する方法、マイクロミリング加工中に薄肉構造の安定性を維持する方法、そして反復のあらゆる段階でリスク管理とユーザビリティエンジニアリングの要件を同時に実現する方法など、より深い理解を得ることができました。
ここに書かれていることは、私たちが日々課題を克服するために活用している核となる方法論です。ぜひご信頼ください。お客様の斬新なアイデアを、効率的かつ確実に、信頼できる製品へと形にするために、共に歩みを進めていきましょう。

図1:LS Manufacturingによる機能検証のための包括的なプロトタイプ
医療機器のプロトタイプはなぜ「機能検証」を超える必要があるのでしょうか?
医療機器プロトタイプの最終的な目標は、単に「動作する」モデルになることではなく、厳格な登録・承認プロセスをすべて通過し、人体に安全に適用できる「製品プロトタイプ」を作成することです。したがって、その検証範囲には、使用リスクのライフサイクル全体を網羅する必要があります。
- 滅菌耐性:プロトタイプは完璧な動作機能を備えていても、高温高圧、放射線照射、化学薬品浸漬といった繰り返しの滅菌プロセスに耐えられない場合があります。材料の経年劣化により性能が低下し、臨床感染を引き起こす可能性があります。プロトタイプ段階では、適合する材料を選定し、検証する必要があります。
- 生体適合性の概要:患者に直接または間接的に接触する部品は、非毒性かつ非アレルギー性の材料で作られなければなりません。設計プロセスの後半で生体適合性材料に置き換えると、機械的特性に影響を与え、構造全体の再設計が必要になる場合があります。
- 安全性とEMC(電磁両立性):能動デバイスの場合、プロトタイプでは、動作中に外部干渉の影響を受けずに他の機器への影響を回避するために、電気絶縁、リーク電流、その他の安全性指標を事前に考慮する必要があります。後から修正を加えると天文学的なコストがかかり、登録および試験において必ず対処しなければなりません。
医療機器のプロトタイプ開発に規制遵守の要件を組み込むことは、実際には積極的なリスク管理アプローチです。これにより、登録・試験、あるいは臨床検証中に機能上の問題が発生することによる大幅な設計変更を回避し、時間と費用を大幅に節約できるだけでなく、製品発売の迅速化の基盤となります。
png" alt="見積もりを依頼する" width="122" height="133">
ISO 13485 認証はプロトタイプ開発の品質システムにどのような影響を与えますか?
ISO 13485プロトタイプは、潜在的に無計画な活動から、最終製品の安全性と有効性に対する早期の信頼をもたらす、管理され、追跡可能な、重要なプロセスへと昇格させます。コンセプト段階から堅牢な品質システムの構築が求められます。これは特に以下の点に反映されています。
厳格な設計管理と文書管理
試作においては、ISO 13485規格に基づき、設計の入力、出力、レビュー、変更に関する文書化が求められます。顧客要求仕様から図面の改訂記録、設計レビューの結論に至るまで、仕様を完全に文書化する必要があります。これにより、試作品と設計意図の整合性が確保され、有用な「設計履歴」が形成され、その後の登録申請に直接的な証拠となります。
管理された製造とトレーサビリティ
この規格では、主要な試作プロセスの検証と管理が求められています。例えば、医療グレードの材料を使用する場合、サプライヤーの資格証明書と受入検査記録を提供する必要があります。また、 3Dプリンティングにおける層厚やレーザー出力といった加工装置のパラメータの設定と確認も含まれます。これにより、 このプロトタイピングのプロセスでは一貫性と再現性が確保され、将来の複製や反復のための明確な基盤が提供されます。
リスク管理の早期統合
リスク管理活動は、設計、材料、プロセスに関連する潜在的なリスクを特定し、管理措置を講じるために、試作段階の早期段階から開始する必要があります。これにより、チームは洗浄、滅菌、生体適合性といった安全性に関連する要件を事前に検討し、それらのソリューションをプロトタイプの設計・製造に統合することが求められ、後々の大幅な設計変更の可能性を低減できます。
試作プロセス全体にわたる品質システムの価値は、単にISO 13485認証を取得するだけにとどまりません。これにより、試作自体にとって標準化された透明性の高いフレームワークが構築されます。これは、機能的な「サンプル」であるだけでなく、信頼性が高く、データが完全で、リスク管理された「試作品」となるのです。
生体適合性要件を満たす医療グレードの材料の選択?
医療機器のプロトタイプ開発において、製品の生体適合性と安全性を判断する上で、材料の選択は最初のハードルとなります。適切な材料を選択することで、承認取得におけるリスクを最小限に抑えることができますが、最も重要なのは患者の安全を確保することです。選択ロジックを明確にするために、主要な考慮事項を以下に比較します。
| 考慮の次元 | 基本パス:認証材料の選択 | 上級コース:材料の生物学的評価 |
| 原理 | USP クラス VI や ISO 10993などの成熟した認証を取得した 医療グレードの材料の使用が最優先です。 | 革新的な材料を使用する場合は、 ISO 10993 規格に準拠した完全な生物学的評価が必要になります。 |
適用可能なシナリオ | リスクが低く、明確で迅速なルートを持つほとんどの成熟した材料に適用されます。 | リスクとコストがより高い、新しい革新的な材料や、まったく新しい人間同士の相互作用のシナリオに適用されます。 |
| 重要な証拠 | 材料サプライヤーからの完全な認証証明書とテストレポート。 | 必要な安全性テストの全部または一部を実行するために、適切な設備と資格を備えた研究所を委託します。 |
| 私たちのサポート | 当社は、医療グレードの材料の検証済みデータベースに基づいて、迅速なマッチングと推奨を提供するほか、評価スキームやテストサポートに関するコンサルティングも行います。 | 当社は、プロセス全体にわたってコンプライアンスリスクを軽減できるようお客様をサポートします。 |
試作の初期段階から生体適合性を考慮した計画を立て、検証済みのデータベースから認証済みの材料を選択することで不確実性を最小限に抑えることを強くお勧めします。革新的なニーズに対応するには、生物学的評価の全過程を事前に計画する必要があります。これにより、材料の問題による登録の遅延や設計の中断を最初から回避し、製品の安全性と迅速な市場投入の基盤を築くことができます。

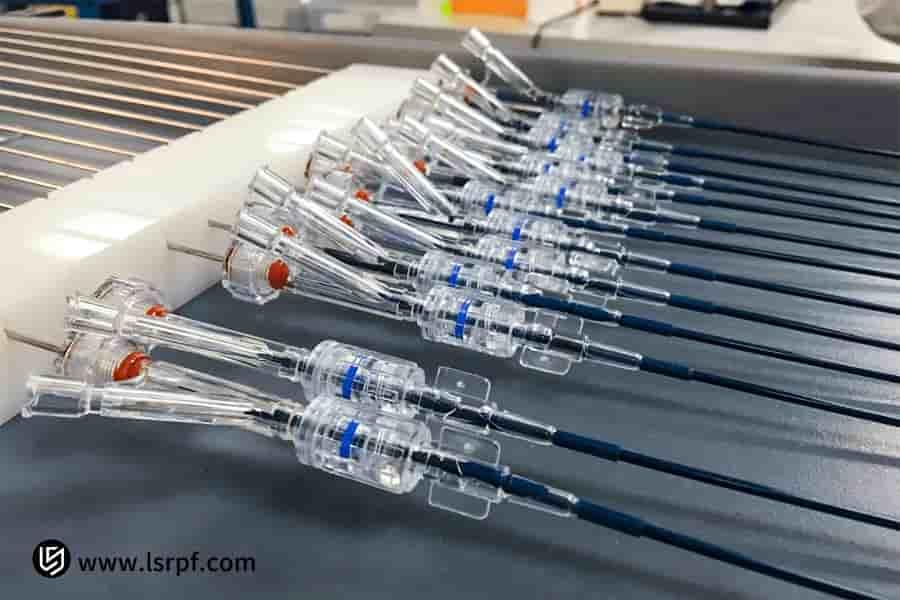
図2:LS Manufacturingによる医療用プロトタイプの正確な容積制御
さまざまな臨床段階のプロトタイプはどのような基準を満たす必要がありますか?
多くの人は、医療機器のプロトタイピングを、一つのバージョンのプロトタイプですべてのニーズを満たそうとする活動だと誤解しています。これは、多くの場合、使用時にリソースが無駄になったり、標準規格が欠如したりすることにつながります。科学がまさに支えているのは、構想から臨床検証までの各段階において、様々な臨床段階の目標に基づいて「まさに最適な」プロトタイプを作成することなのです。
| 臨床ステージ | プロトタイプのコア目標 | 生産基準と戦略 |
| 概念実証 | できるだけ早く設計コンセプトの実現可能性を検証してください。 | 3D プリントのような経済的かつ迅速な方法でコア機能を実現できます。 材料は無限にあります。今こそ迅速な反復が必要な時です。 |
| 機能テスト | プロトタイプの包括的なエンジニアリング テストを実施します。 | 製品のサイズ、材質、性能を忠実に再現したプロトタイプを使用して、製品のパフォーマンスと信頼性を徹底的に検証します。 |
| 動物実験 | 手順の最初のステップは、問題となっている製品の安全性と生体適合性を評価することです。 | 試験が有効となるためには、無菌処理を経て生体適合性のある医療グレードの材料から製造する必要があります。 |
| 臨床検証 | 安全性と有効性のデータは、人間を対象とした試験で取得する必要があります。 | プロトタイプは最終製品を代表するものでなければならず、性能、材料、製造プロセスに関して医療機器の規格に準拠している必要があります。 |
一般的に、医療機器のプロトタイピングは、動的かつ段階的なアプローチで効果的に機能します。 「経済的な」概念実証段階から臨床検証を伴う「準商品化」段階に至るまで、プロトタイプ設計の各段階で、一貫した基準に基づいた特定の目標を設定する必要があります。このような戦略により、初期段階の研究開発コストを効果的に抑制しながら、プロトタイプデータチェーンの完全性と信頼性を確保し、プロトタイプ基準の不一致によるプロジェクトの遅延や失敗を回避できます。
手術器具のプロトタイプにおいて、精度と製造可能性をどのようにバランスさせることができるでしょうか?
手術器具の試作開発プロセスにおいては、機能精度の向上だけでなく、その設計が安定的かつ経済的に量産可能な良質な製品へと転換可能であることを証明することが目標となります。製造性を考慮した設計の原則を最優先に考慮する必要があります。そのため、以下の点を考慮する必要があります。
構造の簡素化と組み立ての最適化
機能性を確保しつつ、部品点数を最小限に抑え、複雑な内部構造を避ける必要があります。例えば、従来の複数部品の組み立て構造の代わりに統合型3Dプリント技術を活用したり、ネジ留めの代わりにセルフロック式のスナップフィット設計を採用したりすることができます。そうすることで、後工程の組み立ての難易度と時間を大幅に削減し、生産効率と一貫性を向上させることができます。
製造プロセスと公差設計のマッチング
試作段階では、精密射出成形や5軸加工といった量産工程を考慮し、合理的な公差を設定する必要があります。嵌合寸法が重要でない場合は、極端な精度を追求する必要はありません。そうでない場合は、加工コストが急激に増加します。設計者は、様々な工程の能力限界を理解し、臨床要件を満たしながら、製造誤差に対して合理的な余裕を持たせる必要があります。
材料および表面処理の大量生産の実現可能性
試作における材料選定は、生体適合性や機械的特性といった要件を満たすだけでなく、サプライチェーンの安定性や量産時のコストも考慮する必要があります。また、抗菌コーティングなどの特殊な表面処理は、実験室サンプルではなく、部品のバッチ処理において安定的かつ均一に施せることが求められます。
外科用器具のプロトタイプは、製造可能性を最初から考慮して設計されます。大規模生産において起こり得る製造、品質、コストの問題を特定し、最適化します。その目的は、製造不可能、あるいは製造コストが高すぎる「完璧な」製品を設計することを避け、プロトタイプから量産への移行をスムーズにすることです。
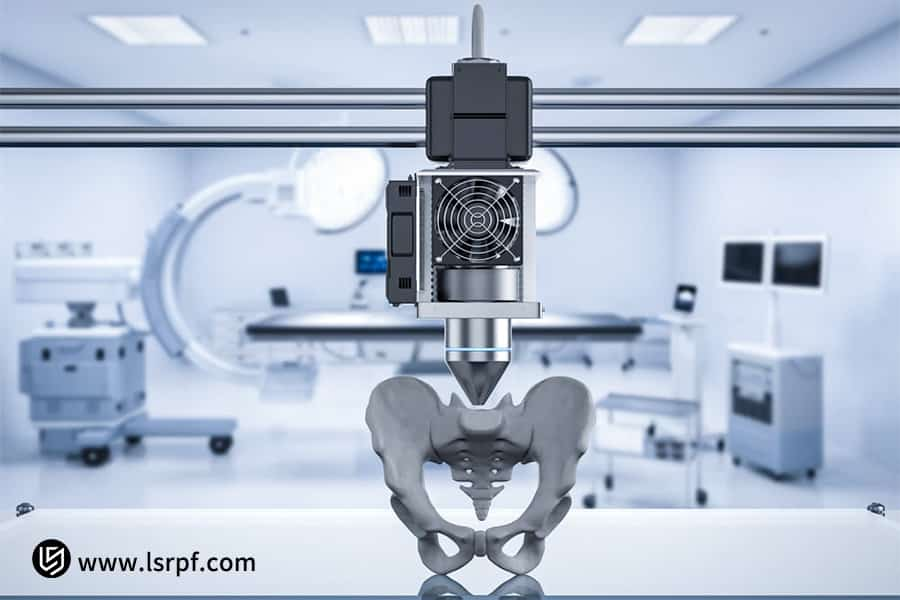
図3:LS Manufacturingによる特注外科用インプラントの加速開発
ラピッドプロトタイピング技術は医療機器のイノベーションをどのように促進するのでしょうか?
医療機器におけるラピッドプロトタイピングの最も重要な価値は、概念設計から物理検証までの期間を短縮し、試行錯誤と反復のための非常に効果的なプラットフォームを提供できることです。これらの技術の中でも、医療グレード3Dプリンティングは革命的な役割を果たしており、その利点と要件は特に以下の点に反映されています。
- 複雑な構造と個別カスタマイズの実現:従来の方法では加工が困難だった複雑なマイクロチャネルや多孔質の海綿骨構造も、医療グレードの3Dプリンティングによって容易に製造できます。これにより、患者の解剖学的構造に正確に適合する個別化された手術ガイドやインプラントの製造が可能になり、精密医療に直接貢献する開発となります。
- 複数の材料と機能の統合:これらの最新のラピッドプロトタイピング技術により、硬質、柔軟、生分解性など、様々な材料を1つのコンポーネントに統合して製造することが可能になります。例えば、硬質フレームワークと柔軟なシールを組み合わせた統合コンポーネントをワンステップで印刷し、実際の臓器を模した解剖モデルや複雑な薬物送達デバイスのプロトタイプに使用することができます。
- 医療用途の特定の要件を満たす: 医療機器のラピッドプロトタイピングでは、どれだけスピードが重要であっても、安全性とコンプライアンスを犠牲にすることはできません。材料は生体適合性がある必要があり、印刷プロセス自体は、品質システム要件に従ってバッチ間の一貫性とプロセス全体のトレーサビリティが確保されるように検証される必要があります。
これらはラピッドプロトタイピング技術の一種であり、医療グレードの3Dプリンティングを活用することで、研究開発チームはこれまで不可能だった設計を低コストかつ記録的な速さで検討できるようになります。材料とプロセスを厳密に管理することで、初期段階から臨床検証、製品登録に至るまで、イノベーションがコンプライアンスに準拠した軌道をたどることを保証します。
LS Manufacturing はどのようにして低侵襲手術器具の技術的ボトルネックの克服を支援しますか?
当社が提供する革新的な医療機器の研究開発における中核的な価値は、医療機器の試作サービスにあります。このサービスを通して、お客様の製品発売における主要な技術的ボトルネックの克服を支援します。以下は、 LS Manufacturingの医療機器試作アプローチの適用例を示す典型的な事例です。
クライアントの課題
ある革新的な企業が、新たな低侵襲手術器具である体腔内吻合デバイスの開発過程において、動物実験で大きな障害に直面しました。コアとなる伝達機構の動作に著しい遅延が生じ、外科医が吻合動作を効果的かつ正確に制御することができませんでした。従来の製造工程の制約により、複雑な内部伝達構造のために、更なる最適化の余地がありませんでした。
LS製造ソリューション
エンジニアリングチームは、従来の機械加工方法を即座に断念しました。医療グレードのステンレス鋼3Dプリント技術を採用し、優れた機械経路と極めて最小限のクリアランスを備えたワンステップ・ワンピースのトランスミッションシステムを製造しました。これにより遅延の問題が解決されただけでなく、この複雑なワンピース成形キャビティに電解研磨を施すことで、標準をはるかに超える表面仕上げを実現し、手術器具に求められる極めて高い滅菌性と清潔さの要件を完全に満たしました。
結果と価値
その後の動物実験では、新たに製作された試作品は完璧に動作し、機器の操作応答速度と精度が約60%向上し、臨床専門家から高い評価を得ました。この技術革新により、クライアントのプロジェクト全体スケジュールは少なくとも5ヶ月短縮され、試行錯誤や金型の修正に要した研究開発費を200万人民元以上削減することができました。
医療グレード3Dプリントなどの先進技術を駆使し、低侵襲手術器具における一般的な構造、材質、性能の限界を克服し、お客様のニーズに対応しました。不可能と思われた技術的課題が、製品の競争力の鍵となり、市場投入までの時間を短縮し、お客様にとって大きなコストメリットを実現しました。

図4:LS Manufacturingによる医療プロトタイプ製造における精密投与
医療機器のプロトタイプ開発にはどのような種類の技術文書が必要ですか?
完全な技術文書は、医療機器登録の成功の礎となります。これは主に、設計管理プロセスを包括的に文書化し、製品の安全性と有効性に関するエビデンスを提供することを目的としています。これは、社内開発のロードマップとなるだけでなく、規制当局に対して、企業の体系的かつコンプライアンスに準拠した開発能力を証明するものとなります。技術文書には、以下の主要文書が含まれますが、これらに限定されるものではありません。
- 設計入力および出力文書:これは文書化システムの始まりです。設計入力は、ユーザーのニーズ、臨床機能、性能指標、規制基準を明確に記録する必要があります。設計出力には、製品図面、技術仕様、部品リストなどが含まれます。すべての入力は、対応する出力につながることを検証する必要があります。
- 材料認証および生体適合性に関する文書:すべての医療グレード材料について、サプライヤーの認証および材料認証に加え、USPクラスVIまたはISO 10993に関連する生体適合性評価または試験報告書も提供する必要があります。これは、製品の生体適合性を確立することに直接関係します。
- 製造プロセス検証記録:詳細なプロセス パラメータ記録、機器の校正証明書、初回品目検査レポートを通じて、プロトタイプの製造プロセスが、 3D 印刷パラメータや滅菌プロセスなど、作成に関係する重要なプロセスごとに一貫しており、制御可能であることを実証します。
言い換えれば、プロトタイピングと並行して行われる基本的な活動として技術文書を作成することは、プロジェクトの効率的な進行を準備するものであり、後付けの作業ではありません。製品の「出生証明書」のような優れた設計管理文書システムは、コンセプトからプロトタイプまでの設計の軌跡を明確に示します。
プロトタイピング段階で登録申請パスを計画するにはどうすればよいでしょうか?
登録申請の適切な準備作業に基づいて、 医療機器開発の加速が保証され、このプロセスで生成されるすべてのデータは、将来の登録書類の強力なサポートとなります。つまり、以下の3つのレベルを体系的に計画する必要があります。
登録の証拠に関する要件を明確に定義する
プロトタイプ設計の入力段階では、対象市場の規制要件を詳細に分析する必要があります。性能指標、生体適合性、電気安全性など、登録審査で確認する必要がある主要な項目は、プロトタイプで検証される具体的な技術パラメータに変換されます。これにより、プロトタイプの開発が最初から適切な規制遵守の軌道に乗ることが保証されます。
プロトタイプ検証データを登録証拠に変換する
プロトタイプは、品質システムの要件に準拠した機能、寿命、およびユーザビリティテストを受けなければなりません。すべてのテストは、事前に承認された標準プロトコルに従って実施する必要があり、これには生データの完全な記録と標準化されたレポートが含まれる必要があります。これは高度に管理されたデータであり、将来の設計検証の核となる証拠として直接提出できるため、繰り返しのテストを回避できます。
設計履歴の文書化のための透明なシステムを確立する
設計入力からレビュー、変更、そして出力に至るまでのプロセスの流れを完全に記録する必要があります。設計管理プロセスにおいて自然に形成されるこの文書化システムは、規制当局に対して設計プロセスが厳格かつ適切に管理されていることを証明するための最良の証拠となり、登録審査の効率と成功率を大幅に向上させることができます。
言い換えれば、試作段階での登録申請の統合を計画することは、医療機器開発を加速するための最良の手段であり、追加登録データのためにプロジェクトの後期段階で発生する高コストと時間遅延を大幅に削減すると同時に、最初から研究開発プロセス全体の標準化と成功率を向上させ、製品の迅速かつ安定した市場投入のための強固な基盤を築きます。
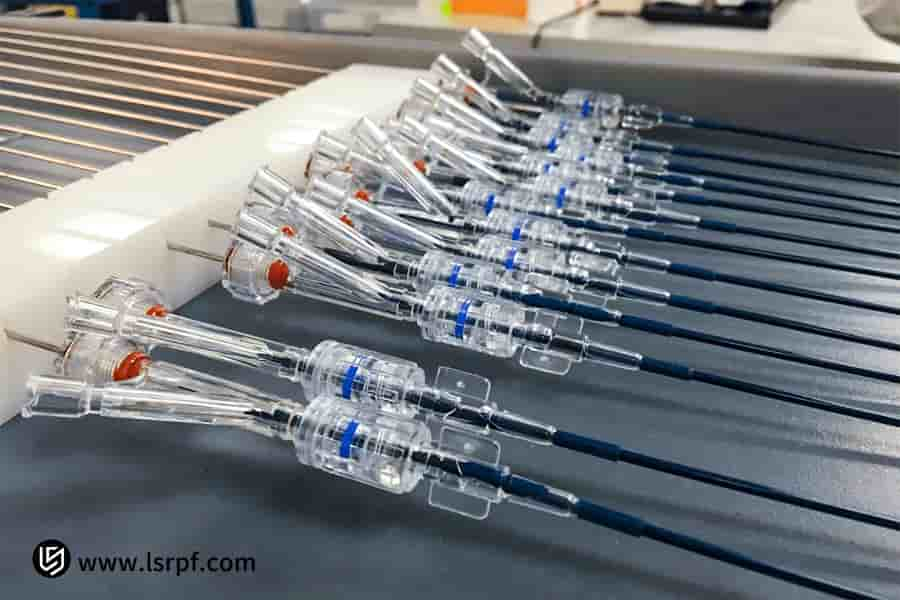
図5: LS Manufacturingによる機能検証用の360度プロトタイプ
よくある質問
1. 医療プロトタイプ機器の開発中は、どのような特定の要件に従う必要がありますか?
さらに、基本的な機能に加え、医療機器に求められる特定の基準を満たすための積極的な取り組みも必要です。当社では、ISO 13485の品質システムを厳格に適用し、これらのプロトタイプが登録段階から生体適合性、滅菌耐性、電気安全性などの規制要件を満たしていることを保証しています。
2. 構想から最初の機能プロトタイプが完成するまでにどれくらいの時間がかかりますか?
デバイスの複雑さによって異なります。比較的シンプルなデバイスは約2~3週間、精密なトランスミッションや電子部品を搭載した複雑なデバイスは4~6週間かかります。当社は、緊急の研究開発ニーズにも柔軟に対応し、プロジェクトスケジュールを完全に保証する迅速な対応チャネルを備えています。
3.臨床試験用デバイスの小ロット製造は可能ですか?
もちろん、当社の多様なサービスの一つとして、 10~100台程度の臨床試験用デバイス小ロット製造も承っております。製造は医療機器製造基準に準拠しており、各ユニットは臨床試験に必要な厳しい性能、品質、そして一貫性を備えて製造されます。
4. プロトタイプ材料の生体適合性をどのように確保しますか?
ISO 10993やUSPクラスVIといった権威ある認証を取得した医療グレードの材料を厳選することで、原料段階からリスクを管理しています。プロトタイプと併せて、材料の完全な認証文書をご提供することも可能です。これにより、生体適合性評価の確固たる証拠となります。
5. プロトタイプ作成プロセス中に IP をどのように保護しますか?
情報セキュリティは私たちの生命線です。すべてのプロジェクトは法的拘束力のある秘密保持契約から始まり、社内では厳格なデータ階層管理とアクセス制御システムを適用しています。クライアントからの要求に応じて、物理ファイアウォールおよび情報ファイアウォールも確立される場合があります。
6. どのような種類の医療機器のプロトタイプをサポートしていますか?
当社が提供するサービスは、診断機器などの能動機器から、手術器具、インプラント、非インプラント機器などの受動機器まで多岐にわたります。LS Manufacturingは、様々な製品に関連する規制やプロセスに精通しています。
7. プロトタイプデータを後続の登録申請で利用できるようにするにはどうすればよいでしょうか?
プロトタイプに加え、詳細な製造記録、工程検査報告書、性能試験データを含む包括的な品質保証パッケージも提供しています。これらはすべて仕様に基づいて作成されており、登録申請をサポートする設計検証資料として直接ご利用いただけます。
8.医療機器のプロトタイププロジェクトを開始するにはどうすればよいですか?
開始するプロセスは非常に簡単です。初期のコンセプトスケッチや技術要件をいくつか記入するだけで、当社のシニアエンジニアが 1 営業日以内にお客様に連絡し、技術的なソリューションについて詳細に話し合い、初期のプロジェクト評価と見積りを提供します。
まとめ
医療機器のプロトタイプは、単なる技術的な実現にとどまりません。リスク管理、規制遵守、そして商業的成功の礎となるものです。適切なプロトタイピングパートナーを見つけることは、製品ライフサイクル全体の確固たる基盤を築くことにつながります。
登録リスクを軽減しながら研究開発を加速させたいとお考えなら、ぜひ当社の医療機器専門家にご相談ください。お客様のプロジェクトに最適な「登録志向型プロトタイピングソリューション」をご提供いたします。医療機器製造における当社の専門的な経験を活かし、お客様のイノベーションの道のりを守ります。
📞電話番号: +86 185 6675 9667
📧メールアドレス: info@longshengmfg.com
🌐ウェブサイト: https://lsrpf.com/
免責事項
このページの内容は情報提供のみを目的としています。LS Manufacturingは、明示的または黙示的を問わず、情報の正確性、完全性、または妥当性について一切の表明または保証を行いません。第三者サプライヤーまたはメーカーが、LS Manufacturingネットワークを通じて性能パラメータ、幾何公差、特定の設計特性、材料の品質と種類、またはプロセスを提供すると推測すべきではありません。この情報に関する責任は購入者が単独で負います。部品のお見積りについては、これらの部品の正確な要件をご指定ください。詳細については、お問い合わせください。
LS製造チーム
LS Manufacturingは、カスタマイズされた製造ソリューションを専門とする業界をリードする企業です。20年以上にわたり5,000社以上のお客様にサービスを提供してきた経験に基づき、高精度CNC加工、板金加工、 3Dプリント、射出成形、金属プレス加工、その他ワンストップ製造サービスに注力しています。
当社工場は最先端の 5 軸加工センターを 100 台以上備えており、ISO 9001:2015 の認証を取得しています。私たちは、世界150以上の国と地域のお客様に、迅速、効率的、そして高品質な製造ソリューションを提供しています。小ロット生産からマスカスタマイゼーションまで、お客様のニーズに24時間以内にお応えします。LS Manufacturingを選ぶということは、効率性、品質、そしてプロフェッショナリズムを選ぶということです。
詳細については、当社の Web サイト( www.lsrpf.com )をご覧ください。