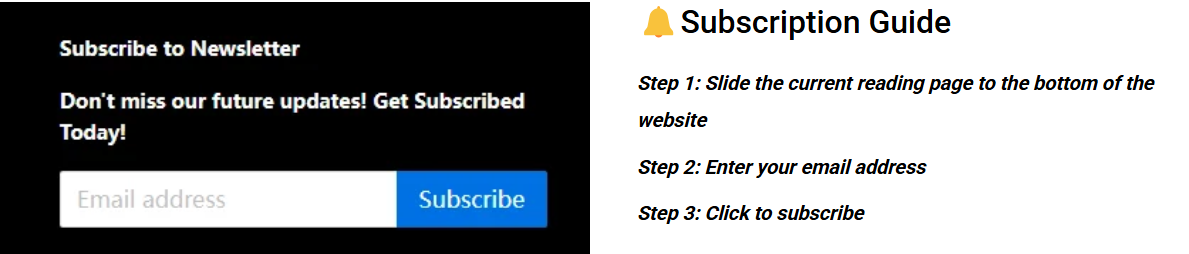
Die Kernaufgabe von Prototypen für Medizinprodukte , die Einhaltung regulatorischer Vorgaben sicherzustellen, unterscheidet sich grundlegend von der Entwicklung allgemeiner technischer Prototypen. Genau hier liegt die Ursache für Missverständnisse bezüglich langsamer Iterationen. Im traditionellen Modell werden funktionale und regulatorische Prüfungen getrennt durchgeführt. Stehen daher regulatorische Herausforderungen wie Biokompatibilität und elektrische Sicherheit bevor, müssen später drastische Änderungen am Prototyp vorgenommen werden, was klinische Studien und die Zulassung erheblich verzögert.
Die Strategie „ Registrierungsorientiertes Prototyping “ bei LS Manufacturing integriert die regulatorischen Anforderungen systematisch von der Designphase an. Sie räumt Normen höchste Priorität ein, um die Erfüllung der wichtigsten Registrierungselemente in Verbindung mit der funktionalen Realisierung des Prototyps sicherzustellen. Dadurch wird der Prototyp für die klinische Validierung und die Registrierungsprüfung qualifiziert und somit ein erfolgreicher Produktlaunch beim ersten Versuch gewährleistet. Um Ihnen Zeit zu sparen, finden Sie hier eine kurze Übersicht der wichtigsten Ergebnisse.
Kurzanleitung zur Prototypentwicklung für Medizinprodukte
| Modul | Wichtigste Erkenntnis |
| Kernkonzept | Erstellen Sie „ registrierungsorientierte Prototypen “, die Funktionalität mit der Einhaltung gesetzlicher Vorschriften verbinden. |
| Traditionelle Schmerzpunkte | Die späte Einführung regulatorischer Anforderungen im Entwicklungsprozess führt zu wiederholten Änderungen am Prototyp und verzögert somit die Markteinführung. |
| Schlüsselelemente | Biokompatibilität, Benutzerfreundlichkeit und Risikomanagement müssen in der Prototyping-Phase gemeinsam behandelt werden. |
| Lösung | Durch proaktive regulatorische Aufsicht und paralleles Arbeiten gelingt das Design von Anfang an. |
| Ultimativer Wert | Das Registrierungsrisiko wird drastisch reduziert und der gesamte Produkteinführungszyklus erheblich verkürzt. |
Die folgende Tabelle veranschaulicht, wie die Entwicklung von Medizinprodukten durch eine Änderung der regulatorischen Anforderungen beschleunigt werden kann. Von einer „Hürde im späten Stadium“ hin zu einem „Design-Input im frühen Stadium“. Die Bewegung hin zu einem „registrierungsorientierten“ Ansatz bedeutet, dass der Prototyp selbst zur Grundlage für die Registrierung wird, ohne störende Änderungen im Nachhinein, mit dem Ziel einer effizienten, zuverlässigen und schnellen Markteinführung.
Warum Sie diesem Leitfaden vertrauen sollten? Praktische Erfahrungen von LS Manufacturing-Experten
Es gibt Tausende von Artikeln online zum Thema Prototyping von Medizinprodukten – warum sollten Sie also Ihre Zeit mit diesem hier verbringen? Was wir hier vorstellen, ist keine Definition aus einem Lehrbuch, sondern vielmehr eine praktische Richtlinie, die den strengen Vorgaben der ISO 13485 und ISO 9001 entspricht und durch unzählige Operationen und Testergebnisse validiert wurde.
Seit über einem Jahrzehnt fertigt unser Team mehr als 50.000 kundenspezifische Prototypen, die den Anforderungen der ISO 13485 für Medizinprodukte entsprechen. Jedes Projekt hat uns ein tieferes Verständnis dafür vermittelt, wie die Schnittparameter für biologisch abbaubare Magnesiumlegierungen ohne thermische Schäden eingestellt werden können, wie die Stabilität dünnwandiger Strukturen beim Mikrofräsen gewährleistet wird und wie die Anforderungen des Risikomanagements und der Benutzerfreundlichkeit in jedem Iterationsschritt gleichzeitig umgesetzt werden können.
Vertrauen Sie uns, die hier beschriebene Methodik ist der Kern unserer täglichen Arbeit, mit der wir Herausforderungen meistern. Lassen Sie uns gemeinsam Ihre innovativen Ideen effizient und zuverlässig in vertrauenswürdige Produkte umsetzen.

Abbildung 1: Umfassender Prototyp zur Funktionsprüfung durch LS Manufacturing
Warum sollten Prototypen von Medizinprodukten über die „funktionale Validierung“ hinausgehen?
Das oberste Ziel des Prototyps eines Medizinprodukts ist nicht nur ein funktionsfähiges Modell, sondern ein Produktprototyp , der alle anspruchsvollen Registrierungs- und Zulassungsverfahren erfolgreich durchläuft und sicher am menschlichen Körper angewendet werden kann. Daher muss die Validierung den gesamten Lebenszyklus und alle damit verbundenen Nutzungsrisiken umfassen.
- Sterilitätstoleranz: Ein Prototyp kann zwar einwandfreie Motorfunktionen aufweisen, ist aber möglicherweise nicht für wiederholte Sterilisationsprozesse wie hohe Temperaturen und Drücke, Bestrahlung oder chemische Behandlung geeignet. Materialalterung kann die Leistung beeinträchtigen und zu klinischen Infektionen führen. Geeignete Materialien müssen daher bereits in der Prototypenphase ausgewählt und validiert werden.
- Überblick zur Biokompatibilität: Teile, die direkt oder indirekt mit Patienten in Kontakt kommen , müssen aus ungiftigen und nicht allergenen Materialien bestehen . Der spätere Austausch durch biokompatible Materialien im Entwicklungsprozess kann die mechanischen Eigenschaften beeinträchtigen und eine vollständige strukturelle Neukonstruktion erforderlich machen.
- Sicherheit und EMV (Elektromagnetische Verträglichkeit): Bei aktiven Geräten müssen Prototypen im Vorfeld auf elektrische Isolation, Ableitstrom und andere Sicherheitsindikatoren geprüft werden, um Störungen anderer Geräte im Betrieb zu vermeiden, ohne selbst durch externe Störungen beeinträchtigt zu werden. Eine spätere Korrektur ist extrem kostspielig und muss daher bei der Registrierung und Prüfung unbedingt berücksichtigt werden.
Die Integration der Anforderungen regulatorischer Vorgaben in die Prototypenentwicklung von Medizinprodukten stellt einen proaktiven Risikomanagementansatz dar. Dadurch lassen sich drastische Designänderungen aufgrund von Funktionsproblemen während der Registrierung, Prüfung oder klinischen Validierung vermeiden – was erheblich Zeit und Kosten spart – und die Grundlage für eine beschleunigte Produkteinführung schaffen .
png" alt="Angebot anfordern" width="122" height="133">
Wie wirkt sich die ISO 13485-Zertifizierung auf das Qualitätssystem für die Prototypenentwicklung aus?
Der ISO 13485-Prototyp hebt den Prozess von einer potenziell zufälligen Aktivität auf ein kontrolliertes, nachvollziehbares und essentielles Verfahren , das frühzeitig Vertrauen in die Sicherheit und Wirksamkeit des Endprodukts schafft. Er fordert ein robustes Qualitätssystem von der Konzeptphase an. Dies spiegelt sich insbesondere in Folgendem wider:
Strenge Designvorgaben und Dokumentationsmanagement
Für die Prototypenerstellung ist eine Dokumentation der Designeingaben, -ergebnisse, -prüfungen und -änderungen gemäß ISO 13485 erforderlich. Vollständig dokumentierte Spezifikationen sind notwendig, von den Kundenanforderungen über Zeichnungsrevisionsprotokolle bis hin zu den Ergebnissen der Designprüfung. Dies gewährleistet die Übereinstimmung zwischen Prototyp und Designabsicht und bildet eine aussagekräftige „Designhistorie“, die als direkter Nachweis für spätere Registrierungsanträge dient.
Kontrollierte Fertigung und Rückverfolgbarkeit
Dieser Standard erfordert die Überprüfung und Kontrolle wichtiger Prototyping-Prozesse. Beispielsweise müssen im Hinblick auf die verwendeten medizinischen Materialien Lieferantenqualifikationszertifikate und Wareneingangsprüfprotokolle vorgelegt werden ; außerdem umfasst er die Einrichtung und Bestätigung der Parameter von Bearbeitungsanlagen, wie etwa Schichtdicke und Laserleistung beim 3D-Druck . Dadurch wird sichergestellt, dass… Konsistenz und Wiederholbarkeit in diesem Prototyping-Prozess schaffen eine klare Grundlage für zukünftige Replikationen oder Iterationen.
Frühe Integration des Risikomanagements
Risikomanagementmaßnahmen sollten bereits in der Prototypenphase beginnen, um potenzielle Risiken im Zusammenhang mit Design, Materialien und Prozessen zu identifizieren und entsprechende Kontrollmaßnahmen zu implementieren. Dadurch wird das Team gezwungen , sich frühzeitig mit sicherheitsrelevanten Anforderungen wie Reinigung, Sterilisation und Biokompatibilität auseinanderzusetzen , die Lösungen in Design und Fertigung des Prototyps zu integrieren und so das Risiko größerer Designänderungen im Nachhinein zu minimieren.
Der Nutzen eines Qualitätssystems während des gesamten Prototyping-Prozesses geht weit über den Erhalt eines Zertifikats nach ISO 13485 hinaus. Dadurch entsteht für den Prototyp selbst ein standardisiertes und transparentes Rahmenwerk ; nicht nur ein funktionales „Muster“, sondern ein zuverlässiges, datenvollständiges und risikokontrolliertes „ Vorprodukt “.
Auswahl von Materialien in medizinischer Qualität, die die Anforderungen an die Biokompatibilität erfüllen?
Die Materialauswahl ist die erste Hürde bei der Bestimmung der Biokompatibilität und Sicherheit eines Medizinproduktprototyps . Die Wahl eines geeigneten Materials minimiert die Risiken bei der Zulassung und gewährleistet vor allem die Patientensicherheit. Um die Auswahlkriterien zu verdeutlichen, werden die wichtigsten Aspekte im Folgenden verglichen.
| Betrachtungsdimensionen | Grundlegender Ablauf: Auswahl zertifizierter Materialien | Weiterführender Pfad: Biologische Bewertung von Materialien |
| Prinzip | Die Verwendung von Materialien in medizinischer Qualität mit ausgereiften Zertifizierungen, wie z. B. USP Klasse VI oder ISO 10993, hat oberste Priorität. | Wird ein innovatives Material verwendet, ist eine vollständige biologische Bewertung nach ISO 10993-Normen erforderlich. |
Anwendbare Szenarien | Gilt für die meisten ausgereiften Materialien mit geringem Risiko und einem klaren, schnellen Weg. | Gilt für neue, innovative Materialien oder völlig neue Szenarien der Mensch-Mensch- Interaktion mit höherem Risiko und höheren Kosten. |
| Wichtigste Beweise | Vollständig ausgefüllte Zertifizierungszertifikate und Prüfberichte des Materiallieferanten. | Beauftragung eines ordnungsgemäß ausgestatteten und qualifizierten Labors zur Durchführung der vollständigen oder teilweisen erforderlichen Sicherheitsprüfungen. |
| Unsere Unterstützung | Wir bieten eine schnelle Zuordnung und Empfehlungen auf Basis einer validierten Datenbank mit Materialien in medizinischer Qualität sowie Beratung zu Bewertungsschemata und Unterstützung bei Tests. | Wir unterstützen unsere Mandanten dabei, Compliance-Risiken während des gesamten Prozesses zu minimieren. |
Wir empfehlen dringend, die Biokompatibilität bereits in der frühen Prototypenphase zu berücksichtigen und vorzertifizierte Materialien aus validierten Datenbanken auszuwählen, um Unsicherheiten zu minimieren . Um innovative Anforderungen zu erfüllen, wird der vollständige biologische Bewertungsprozess frühzeitig geplant. Dadurch lassen sich Verzögerungen bei der Zulassung und Störungen im Design aufgrund von Materialproblemen von vornherein vermeiden und die Grundlage für die Sicherheit und eine schnelle Markteinführung der Produkte schaffen.

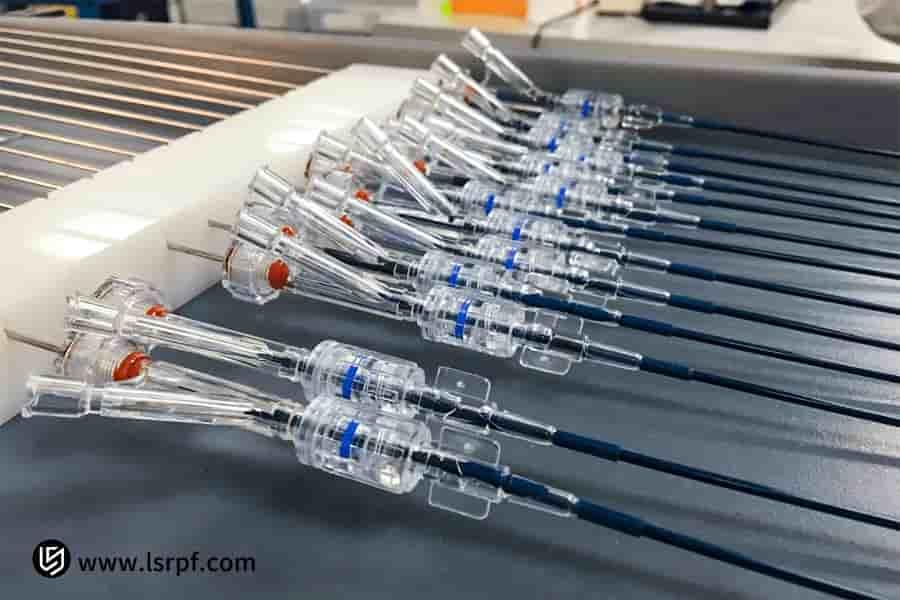
Abbildung 2: Präzise Volumensteuerung für medizinische Prototypen durch LS Manufacturing
Welche Standards sollten Prototypen in verschiedenen klinischen Phasen erfüllen?
Die meisten Menschen missverstehen die Entwicklung von Prototypen für Medizinprodukte als einen Prozess, bei dem ein einziger Prototyp alle Anforderungen erfüllen soll. Dies führt häufig zu Ressourcenverschwendung oder fehlenden Standards. Die Wissenschaft unterstützt jedoch in jedem Schritt – von der Konzeption bis zur klinischen Validierung – die Entwicklung passgenauer Prototypen, die auf die Ziele der jeweiligen klinischen Phase abgestimmt sind.
| Klinisches Stadium | Prototyp Kernziele | Produktionsstandards und -strategien |
| Machbarkeitsnachweis | Prüfen Sie die Machbarkeit des Designkonzepts so schnell wie möglich. | Wirtschaftliche und schnelle Methoden wie der 3D-Druck können Kernfunktionen erfüllen. Die Materialmöglichkeiten sind unbegrenzt; jetzt ist die Zeit für schnelle Iterationen. |
| Funktionstests | Führen Sie umfassende technische Tests an den Prototypen durch. | Gründliche Validierung der Produktleistung und -zuverlässigkeit mithilfe von Prototypen, die hinsichtlich Größe, Material und Leistung dem Produkt möglichst nahekommen. |
| Tierversuche | Der erste Schritt des Verfahrens besteht in der Beurteilung der Sicherheit des betreffenden Produkts und seiner Biokompatibilität . | Es muss aus biokompatiblem , medizinisch zugelassenem Material unter aseptischen Bedingungen hergestellt werden, damit die Tests aussagekräftig sind. |
| Klinische Validierung | Daten zur Sicherheit und Wirksamkeit sollten in Studien am Menschen gewonnen werden. | Der Prototyp muss repräsentativ für das Endprodukt sein und hinsichtlich Leistung, Materialien und Herstellungsverfahren den Normen für Medizinprodukte entsprechen . |
Generell lässt sich sagen, dass die Prototypenentwicklung von Medizinprodukten mit einem dynamischen, aber progressiven Ansatz am effektivsten ist. Von der wirtschaftlichen Machbarkeitsstudie bis hin zur Phase der Quasi-Kommerzialisierung mit klinischer Validierung sollte jede Phase der Prototypenentwicklung bestimmte Ziele mit entsprechenden Standards definieren. Eine solche Strategie hält die F&E-Kosten in der frühen Phase effektiv im Rahmen und gewährleistet gleichzeitig die Integrität und Zuverlässigkeit der Prototypendatenkette . Dadurch werden Projektverzögerungen oder -ausfälle aufgrund nicht übereinstimmender Prototypenstandards vermieden.
Wie lassen sich Präzision und Herstellbarkeit bei Prototypen von chirurgischen Instrumenten in Einklang bringen?
Bei der Entwicklung von Prototypen für chirurgische Instrumente geht es nicht nur um eine höhere Funktionsgenauigkeit, sondern auch um den Nachweis, dass sich das Design stabil und wirtschaftlich in serienfertige Qualitätsprodukte umsetzen lässt. Den Prinzipien der fertigungsgerechten Konstruktion sollte daher höchste Priorität eingeräumt werden. Folgende Punkte sind zu beachten:
Strukturvereinfachung und Montageoptimierung
Bei gleichbleibender Funktionalität sollte die Anzahl der Bauteile minimiert und komplexe interne Strukturen vermieden werden. Beispielsweise könnte integrierte 3D-Drucktechnologie anstelle herkömmlicher, mehrteiliger Montagekonstruktionen eingesetzt oder selbstsichernde Schnappverbindungen anstelle von Schraubverbindungen verwendet werden. Dadurch lassen sich der spätere Montageaufwand und die Montagezeit erheblich reduzieren, was die Produktionseffizienz und -konsistenz verbessert.
Abstimmung von Fertigungsprozessen und Toleranzdesign
In der Prototypenphase sollten die Prozesse der Serienfertigung, wie z. B. Präzisionsspritzguss und 5-Achs-Bearbeitung , berücksichtigt und angemessene Toleranzen festgelegt werden. Höchste Präzision ist nicht erforderlich, wenn die Passungsmaße nicht kritisch sind ; andernfalls steigen die Bearbeitungskosten erheblich. Konstrukteure müssen die Grenzen der verschiedenen Prozesse kennen und ausreichend Spielraum für Fertigungsfehler einplanen, um die klinischen Anforderungen zu erfüllen.
Machbarkeit der Massenproduktion von Materialien und Oberflächenbehandlungen
Bei der Materialauswahl für einen Prototyp sollten neben Biokompatibilität und mechanischen Eigenschaften auch die Stabilität der Lieferkette und die Kosten der Serienproduktion berücksichtigt werden. Spezielle Oberflächenbehandlungen, wie z. B. antibakterielle Beschichtungen, sollten sich zudem stabil und gleichmäßig auf Serienteile und nicht nur auf Labormuster auftragen lassen.
Ein erfolgreicher Prototyp eines chirurgischen Instruments berücksichtigt von Anfang an Aspekte der Herstellbarkeit . Er identifiziert und optimiert mögliche Probleme hinsichtlich Fertigung, Qualität und Kosten für die Serienproduktion . Ziel ist es, die Entwicklung eines „perfekten“ Produkts zu vermeiden, das entweder nicht herstellbar oder zu teuer ist, und einen reibungslosen Übergang vom Prototyp zur Serienproduktion zu gewährleisten.
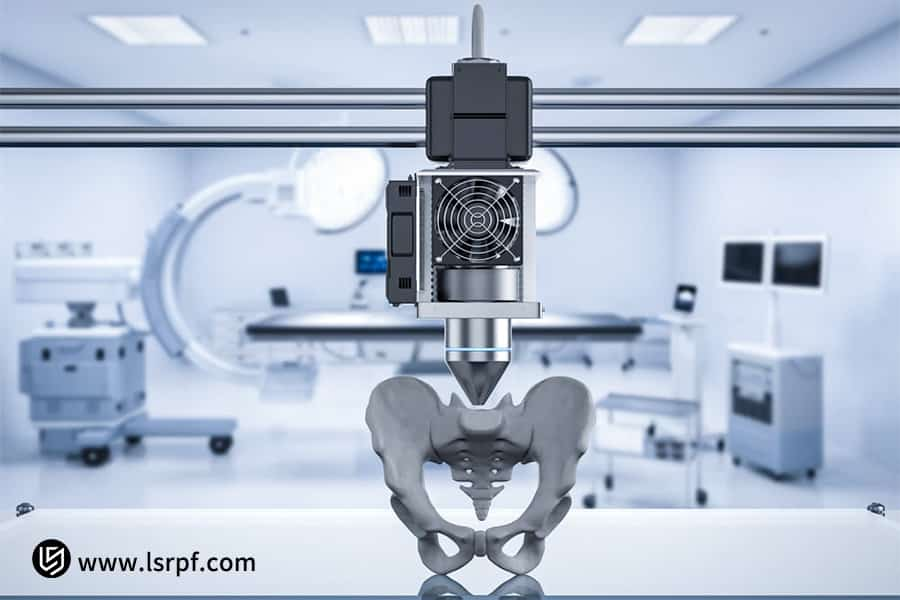
Abbildung 3: Beschleunigte Entwicklung maßgefertigter chirurgischer Implantate durch LS Manufacturing
Wie fördert die Rapid-Prototyping-Technologie Innovationen bei Medizinprodukten?
Der größte Vorteil von Rapid Prototyping für Medizinprodukte liegt in der Verkürzung der Zeitspanne von der Konzeptentwicklung bis zur physischen Prüfung. Dadurch bietet es eine äußerst effektive Plattform für Versuch und Irrtum sowie für iterative Verbesserungen. Unter diesen Technologien spielt der medizinische 3D-Druck eine revolutionäre Rolle. Seine Vorteile und Anforderungen spiegeln sich insbesondere in Folgendem wider:
- Realisierung komplexer Strukturen und personalisierter Anpassung: Komplexe Mikrokanäle und poröse Knochenbälkchenstrukturen, die mit herkömmlichen Methoden schwer zu bearbeiten sind, lassen sich mit medizinischem 3D-Druck problemlos herstellen. Personalisierte Operationsschablonen und Implantate können somit exakt an die Anatomie des Patienten angepasst werden – eine Entwicklung, die direkt zur Präzisionsmedizin beiträgt.
- Integration verschiedener Materialien und Funktionen: Moderne Rapid-Prototyping-Technologien ermöglichen die Herstellung von Bauteilen aus unterschiedlichsten Materialien – von starr und flexibel bis hin zu biologisch abbaubar – innerhalb eines einzigen Bauteils. So lässt sich beispielsweise ein integriertes Bauteil, das ein starres Gerüst mit einer weichen Dichtung kombiniert, in einem einzigen Druckvorgang herstellen. Dieses kann für anatomische Modelle, die reale Organe simulieren, oder für Prototypen komplexer Medikamentenverabreichungssysteme verwendet werden .
- Besondere Anforderungen medizinischer Anwendungen erfüllen: Sicherheit und Konformität dürfen bei der schnellen Prototypenerstellung für medizinische Geräte niemals geopfert werden , egal wie viel Zeit auf dem Spiel steht.Die Materialien müssen biokompatibel sein, und der Druckprozess selbst muss so validiert werden, dass er eine gleichbleibende Qualität von Charge zu Charge und eine Rückverfolgbarkeit während des gesamten Prozesses gemäß den Anforderungen des Qualitätssystems gewährleistet.
Hierbei handelt es sich um eine Klasse von Rapid-Prototyping-Technologien, bei denen der 3D-Druck in medizinischer Qualität es dem Forschungs- und Entwicklungsteam ermöglicht, bisher unmögliche Designs kostengünstiger und in Rekordzeit zu realisieren. Die strenge Kontrolle von Materialien und Prozessen gewährleistet, dass Innovationen von der ersten Phase bis zur klinischen Validierung und Produktregistrierung den regulatorischen Vorgaben entsprechen.
Wie trägt LS Manufacturing dazu bei, den technologischen Engpass bei minimalinvasiven chirurgischen Instrumenten zu überwinden?
Der Kernwert unserer Forschung und Entwicklung innovativer Medizinprodukte liegt in unseren Prototyping-Dienstleistungen, die Kunden dabei unterstützen, die wichtigsten technologischen Hürden bei der Produkteinführung zu überwinden. Das folgende Beispiel veranschaulicht die Anwendung des Prototyping-Ansatzes von LS Manufacturing für Medizinprodukte :
Herausforderung für den Kunden
Bei der Entwicklung eines neuartigen minimalinvasiven chirurgischen Instruments – eines intrakavitären Anastomosengeräts – stieß ein innovatives Unternehmen in Tierversuchen auf erhebliche Schwierigkeiten. Der zentrale Übertragungsmechanismus zeigte eine deutliche Verzögerung und ermöglichte den Chirurgen keine effektive und präzise Kontrolle des Anastomosenvorgangs. Aufgrund der komplexen internen Übertragungsstruktur und der Einschränkungen des traditionellen Herstellungsverfahrens war keine weitere Optimierung möglich.
LS Fertigungslösung
Unser Ingenieurteam griff ein und verwarf umgehend das herkömmliche Bearbeitungsverfahren. Wir setzten stattdessen auf 3D-Drucktechnologie mit medizinischem Edelstahl und fertigten ein einstufiges, einteiliges Übertragungssystem mit optimierter mechanischer Führung und minimalem Spiel. Dadurch wurde nicht nur das Problem der Verzögerung gelöst; die komplexe, einteilig geformte Kavität wurde zusätzlich elektropoliert. Das Ergebnis ist eine Oberflächengüte, die die Standards weit übertrifft und die extrem hohen Anforderungen an Sterilität und Reinheit für chirurgische Instrumente perfekt erfüllt.
Ergebnisse und Wert
In nachfolgenden Tierversuchen funktionierte der neu gefertigte Prototyp einwandfrei, und die Reaktionsgeschwindigkeit und Genauigkeit des Instruments verbesserten sich um etwa 60 % , was ihm großes Lob von klinischen Experten einbrachte. Dieser technologische Durchbruch beschleunigte den Gesamtzeitplan des Kunden somit um mindestens fünf Monate und sparte über zwei Millionen RMB an F&E-Kosten ein, die durch wiederholte Versuche und Formmodifikationen entstanden wären.
Wir setzten fortschrittliche Technologien wie den medizinischen 3D-Druck ein, um die gängigen Struktur-, Material- und Leistungsbeschränkungen minimalinvasiver chirurgischer Instrumente für unsere Kunden zu überwinden. Was zunächst wie unlösbare technische Herausforderungen aussah, erwies sich als entscheidender Wettbewerbsvorteil und sicherte unseren Kunden wertvolle Markteinführungszeiten sowie erhebliche Kostenvorteile.

Abbildung 4: Präzisionsdosierung bei der Herstellung medizinischer Prototypen durch LS Manufacturing
Welche Art von technischer Dokumentation ist für die Prototypenentwicklung von Medizinprodukten erforderlich?
Eine vollständige technische Dokumentation ist die Grundlage für eine erfolgreiche Zulassung von Medizinprodukten. Sie dient primär der umfassenden Dokumentation des Designkontrollprozesses und dem Nachweis der Sicherheit und Wirksamkeit des Produkts. Sie dient nicht nur als Leitfaden für die interne Entwicklung, sondern belegt gegenüber den Zulassungsbehörden auch die systematische und regelkonforme Entwicklungskompetenz des Unternehmens. Die Dokumentation umfasst unter anderem die folgenden Schlüsseldokumente:
- Design-Input- und -Output-Dokumente: Dies ist der Ausgangspunkt des Dokumentationssystems: Design-Inputs, die Benutzerbedürfnisse, klinische Funktionen, Leistungsindikatoren und regulatorische Standards klar dokumentieren. Design-Outputs umfassen Produktzeichnungen, technische Spezifikationen, Stücklisten usw. Jeder Input muss einen entsprechenden Output aufweisen.
- Materialzertifizierung und Dokumentation zur Biokompatibilität: Lieferantenzertifizierungen und Materialzertifikate für alle Materialien in medizinischer Qualität sowie Biokompatibilitätsbewertungen oder Prüfberichte gemäß USP Klasse VI oder ISO 10993 müssen vorliegen. Dies ist für den Nachweis der Biokompatibilität des Produkts von direkter Bedeutung.
- Validierungsdokumentation des Herstellungsprozesses: Es ist nachzuweisen, dass der Herstellungsprozess des Prototyps für jeden kritischen Prozessschritt, der an seiner Erstellung beteiligt ist, wie z. B. 3D-Druckparameter oder Sterilisationsprozesse , konsistent und kontrollierbar ist. Dies kann durch detaillierte Prozessparameteraufzeichnungen, Gerätekalibrierungszertifikate und Erstmusterprüfberichte erfolgen.
Anders ausgedrückt: Die Erstellung der technischen Dokumentation als grundlegende Aktivität parallel zur Prototypentwicklung gewährleistet einen effizienten Projektfortschritt und ist keine Nebensache. Ein gutes Dokumentationssystem zur Designkontrolle , quasi die „Geburtsurkunde“ des Produkts, zeigt den Designprozess vom Konzept bis zum Prototyp transparent auf.
Wie lässt sich der Ablauf des Registrierungsantrags während der Prototyping-Phase planen?
Auf der Grundlage einer soliden Vorbereitung der Zulassungsanmeldung kann die beschleunigte Entwicklung von Medizinprodukten sichergestellt werden, wobei jedes generierte Datenelement eine starke Grundlage für die späteren Zulassungsunterlagen bildet. Das heißt, die folgenden drei Ebenen sollten systematisch geplant werden:
Klare Definition der Anforderungen an den Registrierungsnachweis
Die Entwurfsphase des Prototyps erfordert eine eingehende Analyse der regulatorischen Anforderungen des Zielmarktes. Wichtige Kriterien, die bei der Überprüfung von Zulassungen geprüft werden müssen, wie Leistungsindikatoren, Biokompatibilität und elektrische Sicherheit, werden in spezifische technische Parameter übersetzt, die am Prototyp verifiziert werden. Dadurch wird sichergestellt, dass der Prototyp von Anfang an alle relevanten Vorschriften erfüllt.
Die Validierungsdaten des Prototyps werden in Registrierungsnachweise umgewandelt.
Der Prototyp ist Funktions-, Lebensdauer- und Benutzerfreundlichkeitstests gemäß den Anforderungen des Qualitätssystems zu unterziehen. Alle Tests müssen nach einem vorab genehmigten Standardprotokoll durchgeführt werden, das eine vollständige Aufzeichnung der Rohdaten und einen standardisierten Bericht umfasst.Es handelt sich dabei um streng kontrollierte Daten, die dann direkt als zentrale Nachweise für zukünftige Designvalidierungen verwendet werden können, wodurch wiederholte Tests vermieden werden.
Ein transparentes System zur Dokumentation der Entwurfsgeschichte etablieren
Es sollte den gesamten Prozess von der Designeingabe über die Überprüfung und Änderungen bis hin zum Ergebnis vollständig dokumentieren. Dieses im Designkontrollprozess natürlich entstandene Dokumentationssystem kann sich als bester Nachweis gegenüber den Aufsichtsbehörden erweisen, dass der Designprozess streng und kontrolliert durchgeführt wurde, was die Effizienz und Erfolgsquote von Zulassungsprüfungen erheblich verbessern kann.
Anders ausgedrückt: Die Integration der Zulassungsanträge bereits in der Prototypenphase ist der beste Hebel zur Beschleunigung der Entwicklung von Medizinprodukten . Dadurch werden die hohen Kosten und Zeitverzögerungen, die in späteren Projektphasen aufgrund zusätzlicher Zulassungsdaten entstehen, deutlich reduziert. Gleichzeitig werden die Standardisierung und die Erfolgsquote des gesamten F&E-Prozesses von Anfang an verbessert, wodurch eine solide Grundlage für eine schnelle und stabile Markteinführung der Produkte geschaffen wird.
Abbildung 5: 360-Grad-Prototyp zur Funktionsvalidierung durch LS Manufacturing
Häufig gestellte Fragen
1. Welche spezifischen Anforderungen müssen bei der Entwicklung von medizinischen Prototypen beachtet werden?
Darüber hinaus muss neben der grundlegenden Funktionalität proaktiv auf die Einhaltung der spezifischen Normen für Medizinprodukte eingegangen werden. Wir wenden das Qualitätsmanagementsystem ISO 13485 konsequent an, um sicherzustellen, dass diese Prototypen von Beginn ihrer Registrierung an die regulatorischen Anforderungen hinsichtlich Biokompatibilität, Sterilisationstoleranz, elektrischer Sicherheit und anderer Aspekte erfüllen.
2. Wie lange dauert es von der Konzeption bis zur Fertigstellung des ersten funktionsfähigen Prototyps?
Das hängt von der Komplexität des Geräts ab. Relativ einfache Geräte benötigen etwa 2–3 Wochen, während komplexere Geräte mit Präzisionsgetrieben und elektronischen Bauteilen 4–6 Wochen in Anspruch nehmen. Wir verfügen über einen beschleunigten Prozess, um schnell und flexibel auf dringende F&E-Anforderungen reagieren und Ihren Projektzeitplan vollständig garantieren zu können.
3. Ist es möglich, Kleinserien von Medizinprodukten für klinische Studien herzustellen?
Selbstverständlich gehört auch die Herstellung von Kleinserien klinischer Prüfgeräte ( 10–100 Stück ) zu unseren vielfältigen Dienstleistungen. Die Fertigung erfolgt nach den Standards für die Herstellung von Medizinprodukten , und jedes Gerät erfüllt die hohen Anforderungen an Leistung, Qualität und Konsistenz für klinische Studien.
4. Wie stellen Sie die Biokompatibilität der Prototypmaterialien sicher?
Wir minimieren Risiken von Anfang an durch die strenge Auswahl von Materialien in medizinischer Qualität mit anerkannten Zertifizierungen wie ISO 10993 oder USP Klasse VI. Vollständige Materialzertifizierungsdokumente können zusammen mit dem Prototyp bereitgestellt werden und liefern so eine solide Grundlage für Ihre Biokompatibilitätsbewertung.
5. Wie schützen Sie unser geistiges Eigentum während des Prototyping-Prozesses?
Informationssicherheit ist für uns lebenswichtig. Jedes Projekt beginnt mit einer rechtsverbindlichen Vertraulichkeitsvereinbarung, und intern wenden wir ein strenges Datenhierarchie-Management- und Zugriffskontrollsystem an.Auf Wunsch des Kunden können auch physische und Informationsfirewalls eingerichtet werden.
6. Welche Art von Prototypen medizinischer Geräte unterstützen Sie?
Das Leistungsspektrum unseres Unternehmens reicht von aktiven Geräten wie Diagnosegeräten bis hin zu passiven Geräten wie chirurgischen Instrumenten, Implantaten und nicht-implantierbaren Medizinprodukten . LS Manufacturing ist mit den Vorschriften und Prozessen im Zusammenhang mit den verschiedenen Produkten bestens vertraut.
7. Wie können die Prototypdaten für die Verwendung in Anträgen zur späteren Registrierung verfügbar gemacht werden?
Neben Prototypen bieten wir ein umfassendes Qualitätsnachweispaket an, das detaillierte Produktionsaufzeichnungen, Prozessprüfberichte und Leistungsprüfdaten umfasst. Alle Dokumente werden gemäß den Spezifikationen erstellt und können direkt als Designverifizierungsmaterial zur Unterstützung von Registrierungsanträgen verwendet werden.
8. Wie startet man ein Prototypenprojekt für ein medizinisches Gerät?
Der Einstieg ist ganz einfach: Sie müssen lediglich einige erste Konzeptskizzen oder technische Anforderungen einreichen, und wir sorgen dafür, dass sich innerhalb eines Werktages ein erfahrener Ingenieur mit Ihnen in Verbindung setzt, um die technischen Lösungen ausführlich zu besprechen und Ihnen eine erste Projektbewertung und ein Angebot zu unterbreiten.
Zusammenfassung
Prototypen für Medizinprodukte sind weit mehr als nur eine technische Umsetzung; sie bilden die Grundlage für Risikomanagement, die Einhaltung regulatorischer Vorgaben und den wirtschaftlichen Erfolg. Die Wahl des richtigen Prototyping-Partners schafft eine solide Basis für den gesamten Produktlebenszyklus.
Wenn Sie also Ihre Forschung und Entwicklung beschleunigen und gleichzeitig Registrierungsrisiken minimieren möchten, kontaktieren Sie noch heute unsere Experten für Medizinprodukte und sichern Sie sich eine „registrierungsorientierte Prototyping-Lösung“ für Ihr Projekt! Profitieren Sie von unserer langjährigen Erfahrung in der Herstellung von Medizinprodukten und schützen Sie Ihre Innovationsreise.
📞Telefon: +86 185 6675 9667
📧E-Mail: info@longshengmfg.com
🌐Website: https://lsrpf.com/
Haftungsausschluss
Die Inhalte dieser Seite dienen ausschließlich Informationszwecken. LS Manufacturing übernimmt keine Gewähr für die Richtigkeit, Vollständigkeit oder Gültigkeit der Informationen. Es ist nicht davon auszugehen, dass Drittanbieter oder Hersteller Leistungsparameter, geometrische Toleranzen, spezifische Konstruktionsmerkmale, Materialqualität und -art oder Prozesse über das Netzwerk von LS Manufacturing bereitstellen. Der Käufer trägt die alleinige Verantwortung für diese Informationen. Für Teileangebote geben Sie bitte die genauen Anforderungen an. Kontaktieren Sie uns für weitere Informationen .
LS-Fertigungsteam
LS Manufacturing ist ein branchenführendes Unternehmen, das sich auf kundenspezifische Fertigungslösungen spezialisiert hat. Mit über 20 Jahren Erfahrung und mehr als 5.000 Kunden konzentrieren wir uns auf hochpräzise CNC-Bearbeitung , Blechbearbeitung , 3D-Druck , Spritzguss , Metallstanzen und weitere Komplettlösungen im Bereich der Fertigung.
Unser Werk verfügt über mehr als 100 hochmoderne Fünf-Achs-Bearbeitungszentren und ist nach ISO 9001:2015 zertifiziert.Wir bieten unseren Kunden in über 150 Ländern und Regionen weltweit schnelle, effiziente und qualitativ hochwertige Fertigungslösungen. Ob Kleinserienfertigung oder individuelle Massenproduktion – wir erfüllen Ihre Anforderungen innerhalb von 24 Stunden. Mit LS Manufacturing entscheiden Sie sich für Effizienz, Qualität und Professionalität.
Weitere Informationen finden Sie auf unserer Website: www.lsrpf.com .