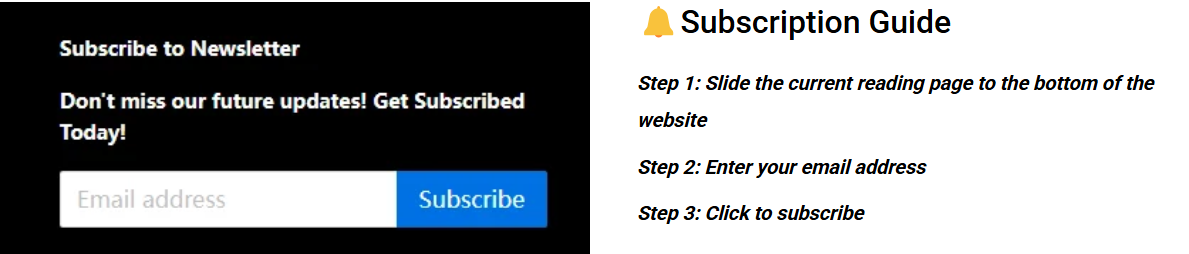
La misión principal de los prototipos de dispositivos médicos , garantizar el cumplimiento normativo, es fundamentalmente diferente a la de los prototipos de ingeniería general. De hecho, esta es la causa principal de las ideas erróneas sobre la iteración lenta. En el modelo tradicional, se separa la verificación funcional de la regulatoria; por lo tanto, al enfrentarse a desafíos regulatorios como la biocompatibilidad y la seguridad eléctrica, es necesario realizar modificaciones drásticas en el prototipo posteriormente, lo que retrasa enormemente los ensayos clínicos y el registro.
La estrategia de " Prototipado Orientado al Registro " de LS Manufacturing integra los requisitos regulatorios de forma sistemática desde la etapa de diseño. Prioriza los estándares para garantizar el cumplimiento de los elementos clave del registro, junto con la realización funcional del prototipo, de modo que este sea apto para la validación clínica y las pruebas de registro, asegurando así el éxito inicial en el lanzamiento del producto. Para ahorrarle tiempo, a continuación presentamos un breve resumen de los hallazgos clave.
Referencia rápida para la creación de prototipos de dispositivos médicos
| Módulo | Conclusión clave |
| Concepto central | Crear “ prototipos dirigidos por registro ” que incorporen la función con el cumplimiento normativo. |
| Puntos de dolor tradicionales | La introducción de requisitos reglamentarios en una etapa tardía del proceso da lugar a modificaciones repetidas del prototipo, lo que retrasa el tiempo de comercialización. |
| Elementos clave | La biocompatibilidad, la ingeniería de usabilidad y la gestión de riesgos deben abordarse conjuntamente en la fase de creación de prototipos. |
| Solución | Obtenga el diseño correcto la primera vez mediante una supervisión regulatoria proactiva y trabajando en paralelo. |
| Valor máximo | Reduciendo drásticamente el riesgo de registro y acortando sustancialmente el ciclo total de lanzamiento del producto. |
La siguiente tabla ilustra cómo acelerar el desarrollo de dispositivos médicos modificando los requisitos regulatorios De un obstáculo de última etapa a una aportación de diseño en la etapa inicial. La transición hacia un enfoque orientado al registro implica que el propio prototipo se convertirá en la base para el registro, sin modificaciones disruptivas posteriores, con el objetivo de un lanzamiento al mercado eficiente, fiable y rápido.
¿Por qué confiar en esta guía? Experiencia práctica de los expertos en fabricación de LS
Existen miles de artículos en línea sobre el prototipado de dispositivos médicos, así que ¿por qué debería dedicar tiempo a leer este? Lo que compartimos aquí no se basa en una definición de libro de texto, sino en unas directrices prácticas sujetas a las rigurosas normas ISO 13485 e ISO 9001 , validadas mediante innumerables cirugías y resultados de pruebas.
Durante más de una década, nuestro equipo ha fabricado más de 50.000 prototipos personalizados que cumplen con los requisitos del sistema de calidad ISO 13485 para dispositivos médicos . Cada proyecto nos proporcionó una comprensión más profunda de cómo establecer los parámetros de corte para aleaciones de magnesio biodegradables sin daño térmico, cómo mantener la estabilidad en estructuras de paredes delgadas durante el microfresado y cómo implementar simultáneamente los requisitos de gestión de riesgos e ingeniería de usabilidad en cada paso de la iteración.
Confíe en nosotros, lo que lee aquí es la metodología fundamental que utilizamos a diario para superar los desafíos. Trabajemos juntos para transformar sus ideas innovadoras con eficiencia y fiabilidad en productos confiables.

Figura 1: Prototipo completo para verificación de funcionalidad por LS Manufacturing
¿Por qué los prototipos de dispositivos médicos deben ir más allá de la “validación funcional”?
El objetivo final del prototipo de dispositivo médico no es simplemente ser un modelo funcional, sino un prototipo de producto capaz de superar todos los rigurosos procesos de registro y aprobación y aplicarse de forma segura en el cuerpo humano. Por lo tanto, su validación debe abarcar todos los riesgos de uso durante su ciclo de vida.
- Tolerancia a la esterilidad: Un prototipo puede tener una función motora perfecta, pero podría no soportar procesos de esterilización repetidos, como altas temperaturas y presiones, irradiación o inmersión química . El envejecimiento del material puede reducir su rendimiento y causar infecciones clínicas. Los materiales que cumplen con los requisitos deben seleccionarse y validarse durante la fase de prototipo .
- Resumen de biocompatibilidad: Las piezas que entran en contacto directo o indirecto con los pacientes deben estar fabricadas con materiales no tóxicos ni alérgicos . Su sustitución por materiales biocompatibles en una fase posterior del diseño puede afectar sus propiedades mecánicas y requerir un rediseño estructural completo.
- Seguridad y compatibilidad electromagnética (EMC): En el caso de dispositivos activos, los prototipos deben considerar previamente el aislamiento eléctrico, la corriente de fuga y otros indicadores de seguridad para evitar, durante el funcionamiento, influir en otros equipos sin verse afectados por interferencias externas. La rectificación posterior tiene un coste astronómico, y es una necesidad que debe abordarse durante el registro y las pruebas.
Integrar los requisitos de cumplimiento normativo en el desarrollo de prototipos de dispositivos médicos es, de hecho, un enfoque proactivo de gestión de riesgos. Esto evitaría cambios drásticos en el diseño debido a problemas de funcionalidad que surgen durante el registro, las pruebas o la validación clínica, lo que supone un importante ahorro de tiempo y dinero, y es la piedra angular para acelerar el lanzamiento del producto .
png" alt="Solicitar cotización" width="122" height="133">
¿Cómo impacta la certificación ISO 13485 en el sistema de calidad para el desarrollo de prototipos?
El prototipo ISO 13485 eleva el proceso de una actividad potencialmente aleatoria a un proceso controlado, trazable y vital que proporciona una confianza temprana en la seguridad y eficacia del producto final. Exige un sistema de calidad sólido desde la fase de concepción. Esto se refleja particularmente en:
Controles estrictos de diseño y gestión de la documentación
Para la creación de prototipos, se requiere documentación de las entradas, salidas, revisiones y cambios del diseño, según la norma ISO 13485. Se requieren especificaciones completamente documentadas, desde las especificaciones de los requisitos del cliente hasta los registros de revisión de los planos y las conclusiones de la revisión del diseño. Esto también proporciona coherencia entre el prototipo y la intención del diseño , y constituye un historial de diseño útil, que proporciona evidencia directa para solicitudes de registro posteriores.
Fabricación controlada y trazabilidad
Esta norma exige la verificación y el control de los procesos clave de prototipado. Por ejemplo, en lo que respecta a los materiales de grado médico, se deben proporcionar certificados de calificación del proveedor y registros de inspección de entrada . También implica la configuración y confirmación de los parámetros del equipo de procesamiento, como el espesor de capa y la potencia del láser en la impresión 3D . Esto garantizaría... consistencia y repetibilidad en este proceso de creación de prototipos y dan una base clara para futuras replicaciones o iteraciones.
Integración temprana de la gestión de riesgos
Las actividades de gestión de riesgos deben comenzar con suficiente antelación durante el prototipado para identificar los posibles riesgos asociados al diseño, los materiales y los procesos que requieren medidas de control. En este sentido, esto obliga al equipo a considerar con antelación los requisitos de seguridad, como la limpieza, la esterilización y la biocompatibilidad , e integrar las soluciones en el diseño y la fabricación del prototipo , lo que reduce la posibilidad de cambios importantes en el diseño posteriormente.
El valor de un sistema de calidad a lo largo de todo el proceso de prototipado va mucho más allá de la simple obtención de un certificado ISO 13485. Esto generará, para el propio prototipo, un marco estandarizado y transparente ; no solo una "muestra" funcional, sino un " preproducto " fiable, con datos completos y con control de riesgos.
¿Selección de materiales de grado médico que cumplan con los requisitos de biocompatibilidad?
La selección es el primer paso para determinar la biocompatibilidad y seguridad del producto durante el desarrollo del prototipo del dispositivo médico . La selección de un material adecuado minimiza los riesgos durante el registro, pero, sobre todo, garantiza la seguridad del paciente. Para aclarar la lógica de selección, a continuación se comparan las consideraciones clave.
| Dimensiones de la consideración | Ruta básica: Selección de materiales certificados | Ruta Avanzada: Evaluación Biológica de Materiales |
| Principio | El uso de materiales de grado médico con certificación madura es lo primero, como USP Clase VI o ISO 10993. | Si se utiliza un material innovador, se requerirá una evaluación biológica completa según las normas ISO 10993 . |
Escenarios aplicables | Se aplica a la mayoría de materiales maduros, de bajo riesgo y que tengan una ruta clara y rápida. | Se aplica a materiales nuevos e innovadores o a escenarios de interacción humano-humano completamente nuevos, de mayor riesgo y coste. |
| Evidencia clave | Certificados de certificación e informes de pruebas completamente completados del proveedor del material. | Poner en funcionamiento un laboratorio debidamente equipado y cualificado para llevar a cabo el conjunto completo o parcial de pruebas de seguridad requeridas. |
| Nuestro apoyo | Proporcionamos compatibilidad rápida y recomendaciones basadas en una base de datos validada de materiales de grado médico , junto con asesoramiento sobre esquemas de evaluación y soporte para pruebas. | Apoyamos a nuestros clientes en la mitigación de riesgos de cumplimiento a lo largo de todo el proceso. |
Recomendamos encarecidamente planificar la biocompatibilidad desde las primeras etapas del prototipado, seleccionando materiales precertificados de bases de datos validadas para minimizar la incertidumbre . Cuando se deban cubrir necesidades innovadoras, se planificará con mucha antelación el proceso completo de evaluación biológica. Esto evitará retrasos en el registro e interrupciones en los diseños debido a problemas con los materiales desde el principio y sentará las bases para la seguridad y el rápido lanzamiento al mercado de los productos.

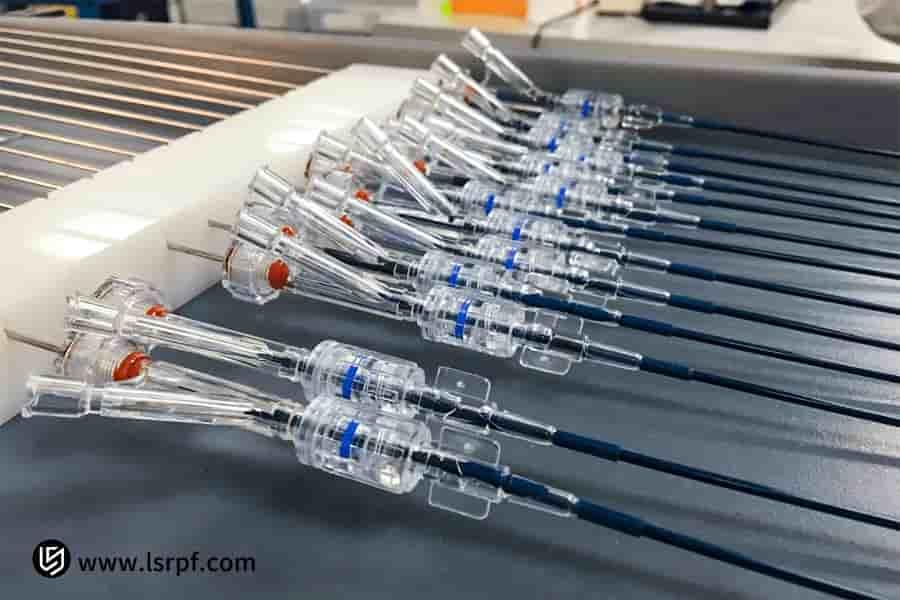
Figura 2: Control volumétrico preciso para prototipos médicos de LS Manufacturing
¿Qué estándares deben cumplir los prototipos en las diferentes etapas clínicas?
Mucha gente malinterpreta el prototipado de dispositivos médicos como una actividad en la que una versión de un prototipo intenta satisfacer todas las necesidades. Esto a menudo resulta en el desperdicio de recursos en su uso o la falta de estándares. Lo que la ciencia apoya precisamente en cada paso, desde el concepto hasta la validación clínica , es la creación de prototipos "perfectos", basados en los objetivos de las diferentes etapas clínicas.
| Estadio clínico | Objetivos fundamentales del prototipo | Estándares y estrategias de producción |
| Prueba de concepto | Verificar la viabilidad del concepto de diseño lo antes posible. | Los métodos económicos y rápidos, como la impresión 3D, pueden lograr funciones fundamentales. Los materiales son ilimitados; ahora es el momento de la iteración rápida. |
| Pruebas funcionales | Realizar pruebas de ingeniería integrales de prototipos. | Validación exhaustiva del rendimiento y la confiabilidad del producto utilizando prototipos que son representaciones cercanas del tamaño, los materiales y el rendimiento del producto. |
| Pruebas con animales | El primer paso del procedimiento es evaluar la seguridad del producto en cuestión y su biocompatibilidad . | Debe prepararse a partir de material de grado médico biocompatible luego de un procesamiento aséptico para que las pruebas sean válidas. |
| Validación clínica | Los datos de seguridad y eficacia deben obtenerse en ensayos realizados en humanos. | El prototipo debe ser representativo del producto final y debe cumplir con las normas de dispositivos médicos con respecto al rendimiento, los materiales y los procesos de fabricación. |
En general, el prototipado de dispositivos médicos funciona eficazmente con un enfoque dinámico pero progresivo. Desde la fase económica de prueba de concepto hasta la fase de "cuasicomercialización" , con la validación clínica , cada etapa del diseño del prototipo debe establecer objetivos específicos con estándares compatibles. Esta estrategia controlará eficazmente los costos iniciales de I+D, a la vez que garantiza la integridad y fiabilidad de la cadena de datos del prototipo , evitando así retrasos o fallos del proyecto debido a la incompatibilidad de los estándares del prototipo.
¿Cómo se puede equilibrar la precisión y la capacidad de fabricación en el prototipo de instrumentos quirúrgicos?
En el proceso de desarrollo de prototipos de instrumental quirúrgico , el objetivo no solo es lograr una mayor precisión funcional, sino también demostrar que su diseño puede transformarse de forma estable y económica en productos cualificados para la producción en masa. Se debe priorizar la viabilidad del diseño. Por lo tanto, se deben considerar los siguientes puntos:
Simplificación estructural y optimización del ensamblaje
Al tiempo que se garantiza la funcionalidad, se debe minimizar el número de piezas y evitar estructuras internas complejas. Por ejemplo, se podría utilizar tecnología de impresión 3D integrada en lugar de las estructuras de ensamblaje tradicionales de varias piezas, o se podrían adoptar diseños de ajuste a presión con autobloqueo en lugar de la fijación con tornillos. De este modo, se puede reducir considerablemente la dificultad y el tiempo de ensamblaje posterior, mejorando así la eficiencia y la consistencia de la producción.
Procesos de fabricación compatibles y diseño de tolerancias
En la etapa de prototipado, se deben considerar los procesos involucrados en la producción en masa, como el moldeo por inyección de precisión y el mecanizado de 5 ejes , y se deben establecer tolerancias razonables. No es necesario buscar una precisión extrema si las dimensiones de acoplamiento no son críticas ; de lo contrario, el costo del procesamiento aumentará considerablemente. Los diseñadores deben comprender los límites de capacidad de los diferentes procesos y dejar márgenes razonables para errores de fabricación, cumpliendo con los requisitos clínicos.
Viabilidad de la producción en masa de materiales y tratamientos superficiales
La selección de materiales para un prototipo debe cumplir no solo con los requisitos de biocompatibilidad y propiedades mecánicas, sino también con la estabilidad de la cadena de suministro y el coste de la producción en masa. Asimismo, los tratamientos superficiales especiales, como el recubrimiento antibacteriano, deben poder implementarse de forma estable y uniforme en lotes de piezas, en lugar de en muestras de laboratorio.
Un prototipo exitoso de instrumento quirúrgico incorpora consideraciones de fabricación desde el principio. Identifica y optimiza posibles problemas de fabricación, calidad y costes para la producción a gran escala . La idea es evitar diseñar un producto "perfecto" que sea improbable o demasiado costoso de fabricar, y también garantizar una transición fluida del prototipo a la producción en masa.
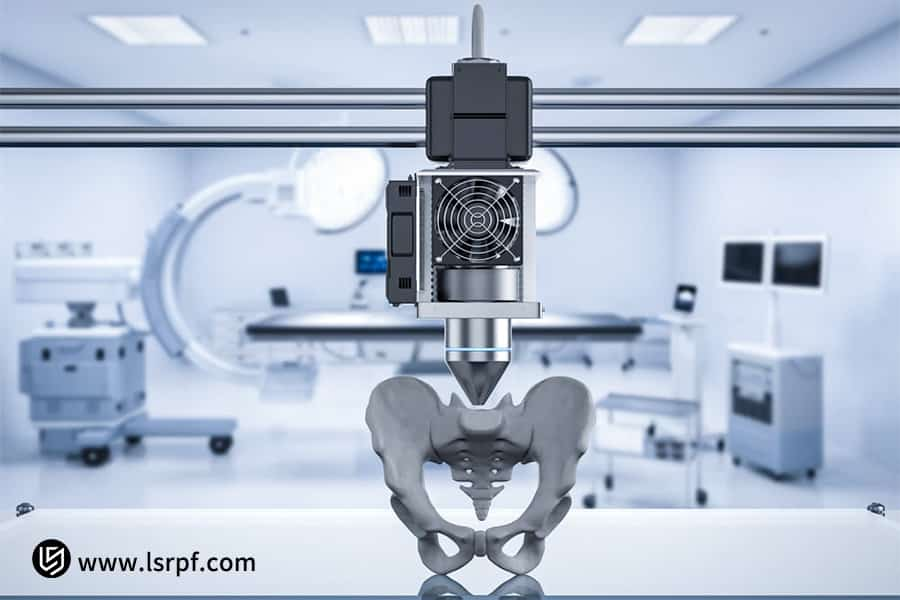
Figura 3: Desarrollo acelerado de implantes quirúrgicos a medida por LS Manufacturing
¿Cómo la tecnología de prototipado rápido facilita la innovación en dispositivos médicos?
El valor más importante del prototipado rápido para dispositivos médicos reside en que permite acortar el tiempo transcurrido desde el diseño conceptual hasta la verificación física, lo que proporciona una plataforma muy eficaz para la prueba y error, así como para la iteración. Entre estas tecnologías, la impresión 3D de grado médico está desempeñando un papel revolucionario, cuyas ventajas y requisitos se reflejan particularmente en:
- Estructuras complejas y personalización: Microcanales complejos y estructuras óseas trabeculares porosas, difíciles de procesar con métodos tradicionales, se pueden producir fácilmente mediante impresión 3D de grado médico . Por lo tanto, se pueden fabricar guías quirúrgicas e implantes personalizados que se ajustan con precisión a la anatomía del paciente, un avance que contribuye directamente a la medicina de precisión.
- Integración de diversos materiales y funciones: Estas modernas tecnologías de prototipado rápido permiten fabricar componentes a partir de una gama de materiales que varían desde rígidos y flexibles hasta biodegradables, todo en un solo componente. Por ejemplo, un componente integrado que combina una estructura rígida con un sello blando puede imprimirse en un solo paso para su uso en modelos anatómicos que simulan órganos reales o prototipos de dispositivos complejos de administración de fármacos.
- Satisfacer los requisitos particulares de las aplicaciones médicas: la seguridad y el cumplimiento nunca se pueden sacrificar en la creación rápida de prototipos para dispositivos médicos , sin importar cuánta velocidad esté en juego.Los materiales deben ser biocompatibles y el propio proceso de impresión debe validarse de tal manera que garantice la consistencia de lote a lote y la trazabilidad durante todo el proceso de acuerdo con los requisitos del sistema de calidad .
Se trata de una clase de tecnologías de prototipado rápido donde la impresión 3D de grado médico permite al equipo de I+D explorar diseños previamente imposibles a un menor coste y en tiempo récord. El riguroso control de los materiales y el proceso garantiza que la innovación siga la normativa vigente desde la fase inicial hasta la validación clínica y el registro del producto.
¿Cómo ayuda LS Manufacturing a que los instrumentos quirúrgicos mínimamente invasivos superen el cuello de botella tecnológico?
El valor fundamental de la I+D de dispositivos médicos innovadores que ofrecemos reside en nuestros servicios de prototipado , que ayudan a nuestros clientes a superar los principales obstáculos tecnológicos en el lanzamiento de sus productos. A continuación, se presenta un caso típico que demuestra la aplicación del enfoque de prototipos médicos de LS Manufacturing :
Desafío del cliente
En el proceso de desarrollo de un nuevo tipo de instrumento quirúrgico mínimamente invasivo —un dispositivo de anastomosis intracavitaria—, una empresa innovadora se enfrentó a importantes obstáculos durante las pruebas con animales. El mecanismo de transmisión central presentaba un retraso significativo en su funcionamiento y no permitía a los cirujanos un control eficaz y preciso de la anastomosis. Debido a las limitaciones del proceso de fabricación tradicional, no había margen para una mayor optimización debido a su compleja estructura de transmisión interna.
Solución de fabricación LS
Tras la intervención, nuestro equipo de ingeniería abandonó de inmediato el método de mecanizado tradicional. Empleamos tecnología de impresión 3D de acero inoxidable de grado médico para fabricar un sistema de transmisión de una sola pieza y un solo paso con una trayectoria mecánica superior y una holgura mínima. Esto no solo solucionó el problema del retardo, sino que también mejoró aún más con la aplicación del electropulido a esta compleja cavidad moldeada de una sola pieza , lo que le proporcionó un acabado superficial que supera con creces los estándares y cumple a la perfección con los exigentes requisitos de esterilidad y limpieza del instrumental quirúrgico.
Resultados y valor
En ensayos posteriores con animales, el prototipo recién fabricado funcionó a la perfección, y la velocidad de respuesta operativa y la precisión del instrumento mejoraron aproximadamente un 60% , lo que le valió elogios de los expertos clínicos. Este avance tecnológico adelantó directamente el cronograma general del proyecto del cliente en al menos 5 meses y ahorró más de 2 millones de RMB en costos de I+D derivados de repetidas pruebas y modificaciones de moldes.
Aplicamos tecnologías avanzadas, como la impresión 3D de grado médico, para superar las limitaciones comunes de estructura, materiales y rendimiento de los instrumentos quirúrgicos mínimamente invasivos de nuestros clientes. Lo que parecían retos técnicos imposibles se convirtió en la clave para la competitividad del producto, asegurando valiosos plazos de comercialización y grandes ventajas en costos para nuestros clientes.

Figura 4: Dosificación de precisión en la fabricación de prototipos médicos por LS Manufacturing
¿Qué tipo de documentación técnica requiere el desarrollo de prototipos en dispositivos médicos?
La documentación técnica completa es fundamental para el registro exitoso de un dispositivo médico. Sirve principalmente para documentar exhaustivamente el proceso de control de diseño y proporcionar evidencia sobre la seguridad y eficacia del producto. Esto no solo servirá como guía para el desarrollo interno, sino que también servirá como evidencia para las agencias reguladoras de la capacidad de desarrollo sistemático y conforme a la normativa de la empresa. Incluirá, entre otros, los siguientes documentos clave:
- Documentos de entrada y salida del diseño: Este es el inicio del sistema de documentación: las entradas de diseño, que registrarán claramente las necesidades del usuario, las funciones clínicas, los indicadores de rendimiento y las normas regulatorias. Las salidas de diseño incluirán planos del producto, especificaciones técnicas, listas de piezas, etc. Cada entrada debe verificarse para obtener su correspondiente salida.
- Certificación de materiales y documentación de biocompatibilidad: Se deben disponer de las certificaciones de los proveedores y los certificados de materiales de todos los materiales de grado médico, junto con las evaluaciones de biocompatibilidad o los informes de pruebas pertinentes para las partes de la USP Clase VI o la ISO 10993. Esto está directamente relacionado con el establecimiento de la biocompatibilidad del producto.
- Registros de validación del proceso de fabricación: demuestre que el proceso de fabricación del prototipo es consistente y controlable para cada proceso crítico involucrado en su creación, como los parámetros de impresión 3D o los procesos de esterilización , a través de registros detallados de parámetros del proceso, certificados de calibración de equipos e informes de inspección del primer artículo.
En otras palabras, significa que la creación de documentación técnica , como actividad básica paralela al prototipado, prepara el terreno para un progreso eficiente del proyecto; no es una idea de último momento. Un buen sistema de documentación de control de diseño , como el "certificado de nacimiento" del producto, muestra claramente la trayectoria del diseño desde el concepto hasta el prototipo.
¿Cómo planificar la ruta de solicitud de registro durante la etapa de prototipado?
Con base en una sólida preparación de la solicitud de registro , se puede asegurar un desarrollo acelerado de dispositivos médicos . En este proceso, cada dato generado se convertirá en un sólido respaldo para futuros documentos de registro. Es decir, se deben planificar sistemáticamente los siguientes tres niveles:
Definición clara de los requisitos relativos a la prueba del registro
La fase de entrada del diseño del prototipo exige un análisis exhaustivo de los requisitos regulatorios del mercado objetivo. Los aspectos principales que deben verificarse durante la revisión de los registros, como los indicadores de rendimiento, la biocompatibilidad y la seguridad eléctrica, se traducen en parámetros técnicos específicos que el prototipo debe verificar. Esto garantizará el desarrollo de un prototipo en la dirección correcta y conforme a la normativa desde el principio.
Transformar los datos de validación del prototipo en evidencia de registro
El prototipo se someterá a pruebas funcionales, de vida útil y de usabilidad que cumplan con los requisitos del sistema de calidad . Todas las pruebas deben realizarse con un protocolo estándar preaprobado, que debe incluir un registro completo de los datos brutos y un informe estandarizado.Estos serán datos altamente controlados que luego podrán presentarse directamente como evidencia central para la futura validación del diseño, evitando así pruebas repetidas.
Establecer un sistema transparente para la documentación del historial de diseño
Debe proporcionar un registro completo del proceso, desde la entrada del diseño hasta la revisión, los cambios y el resultado. Este sistema de documentación, que se genera de forma natural en el proceso de control del diseño, puede ser la mejor prueba para demostrar a las agencias reguladoras que el proceso de diseño es riguroso y controlado, lo que puede mejorar considerablemente la eficiencia y la tasa de éxito de las revisiones de registro.
En otras palabras, planificar la integración de la aplicación de registro en la fase de prototipo es la mejor palanca para acelerar el desarrollo de dispositivos médicos , ya que reduce drásticamente los altos costos y los retrasos en los que se incurre en las fases posteriores del proyecto debido a los datos de registro complementarios, al tiempo que mejora la estandarización y la tasa de éxito de todo el proceso de I+D desde el principio, sentando una base sólida para el lanzamiento rápido y estable de los productos al mercado.
Figura 5: Prototipo de 360 grados para validación funcional por LS Manufacturing
Preguntas frecuentes
1. ¿Qué requisitos específicos deben seguirse durante el desarrollo de prototipos de dispositivos médicos?
Además, más allá de la funcionalidad básica, es necesario abordar proactivamente el cumplimiento de las normas específicas para dispositivos médicos. Aplicamos rigurosamente el sistema de calidad ISO 13485 para garantizar que estos prototipos cumplan con los requisitos regulatorios de biocompatibilidad, tolerancia a la esterilización, seguridad eléctrica y otros aspectos desde el inicio de su registro.
2. ¿Cuánto tiempo transcurre desde el concepto hasta obtener el primer prototipo funcional?
Depende de la complejidad del dispositivo. Los dispositivos relativamente sencillos tardan entre 2 y 3 semanas, mientras que los más complejos, con transmisiones de precisión y componentes electrónicos, tardan entre 4 y 6 semanas . Disponemos de un canal de atención acelerada para atender con flexibilidad las necesidades urgentes de I+D y garantizar el cumplimiento total del cronograma de su proyecto.
3. ¿Es posible fabricar lotes pequeños de dispositivos para ensayos clínicos?
Por supuesto, uno de nuestros diversos servicios es la fabricación de lotes pequeños de dispositivos para ensayos clínicos , de entre 10 y 100 unidades . La fabricación se realizó según los estándares de fabricación de dispositivos médicos , y cada unidad se fabricará con los exigentes estándares de rendimiento, calidad y consistencia necesarios para ensayos clínicos.
4. ¿Cómo se garantiza la biocompatibilidad de los materiales del prototipo?
Controlamos los riesgos desde el origen mediante la estricta selección de materiales de grado médico con certificaciones reconocidas , como ISO 10993 o USP Clase VI. Junto con el prototipo, podemos proporcionar la documentación completa de certificación del material, lo que proporciona evidencia sustancial para su evaluación de biocompatibilidad.
5. ¿Cómo protegemos nuestra propiedad intelectual durante el proceso de creación de prototipos?
La seguridad de la información es nuestra prioridad. Cada proyecto comienza con un acuerdo de confidencialidad legalmente vinculante y, a nivel interno, aplicamos un estricto sistema de gestión de la jerarquía de datos y control de acceso.Si el cliente lo solicita también se podrán establecer firewalls físicos y de información.
6. ¿Qué tipo de prototipos de dispositivos médicos apoyan?
Los servicios que ofrece nuestra empresa abarcan desde dispositivos activos, como equipos de diagnóstico, hasta dispositivos pasivos, como instrumental quirúrgico, implantes y dispositivos no implantables . LS Manufacturing está bien versado en las normativas y procesos asociados a diversos productos.
7. ¿Cómo hacer que los datos del prototipo estén disponibles para su uso en solicitudes de registro posterior?
Además de los prototipos, ofrecemos un paquete completo de evidencia de calidad, que incluye registros detallados de producción, informes de inspección de procesos y datos de pruebas de rendimiento . Todos estos datos se generan según las especificaciones y pueden utilizarse directamente como material de verificación de diseño para respaldar las solicitudes de registro.
8. ¿Cómo iniciar un proyecto de prototipo de dispositivo médico?
El proceso para comenzar es bastante simple: simplemente complete algunos bocetos conceptuales iniciales o requisitos técnicos y nos aseguraremos de que un ingeniero senior se comunique con usted dentro de un día hábil para discutir las soluciones técnicas en profundidad y brindarle una evaluación y cotización inicial del proyecto.
Resumen
Los prototipos de dispositivos médicos son mucho más que una simple realización técnica; son la piedra angular de la gestión de riesgos, el cumplimiento normativo y el éxito comercial. Encontrar el socio de prototipado adecuado sienta las bases para todo el ciclo de vida del producto.
Por lo tanto, si desea acelerar la I+D y reducir los riesgos de registro, contacte hoy mismo con nuestros expertos en dispositivos médicos para obtener una "Solución de Prototipado Orientada al Registro" para su proyecto. Permítanos aplicar nuestra experiencia profesional en la fabricación de dispositivos médicos para proteger su trayectoria de innovación.
📞Teléfono: +86 185 6675 9667
📧Correo electrónico: info@longshengmfg.com
🌐Sitio web: https://lsrpf.com/
Descargo de responsabilidad
El contenido de esta página es meramente informativo. LS Manufacturing no ofrece ninguna garantía, expresa o implícita, sobre la exactitud, integridad o validez de la información. No se debe inferir que proveedores o fabricantes externos proporcionen parámetros de rendimiento, tolerancias geométricas, características específicas de diseño, calidad y tipo de material, ni procesos a través de la red de LS Manufacturing. El comprador es el único responsable de esta información. Para obtener presupuestos de piezas, especifique los requisitos exactos de las mismas. Contáctenos para obtener más información .
Equipo de fabricación de LS
LS Manufacturing es una empresa líder en la industria especializada en soluciones de fabricación a medida. Con más de 20 años de experiencia, atendiendo a más de 5000 clientes, nos especializamos en mecanizado CNC de alta precisión, fabricación de chapa metálica , impresión 3D , moldeo por inyección , estampación metálica y otros servicios integrales de fabricación.
Nuestra fábrica cuenta con más de 100 centros de mecanizado de cinco ejes de última generación y cuenta con la certificación ISO 9001:2015.Ofrecemos soluciones de fabricación rápidas, eficientes y de alta calidad a clientes en más de 150 países y regiones de todo el mundo. Ya sea producción en lotes pequeños o personalización masiva, podemos satisfacer sus necesidades en 24 horas. Elegir LS Manufacturing significa elegir eficiencia, calidad y profesionalismo.
Para obtener más información, visite nuestro sitio web: www.lsrpf.com .