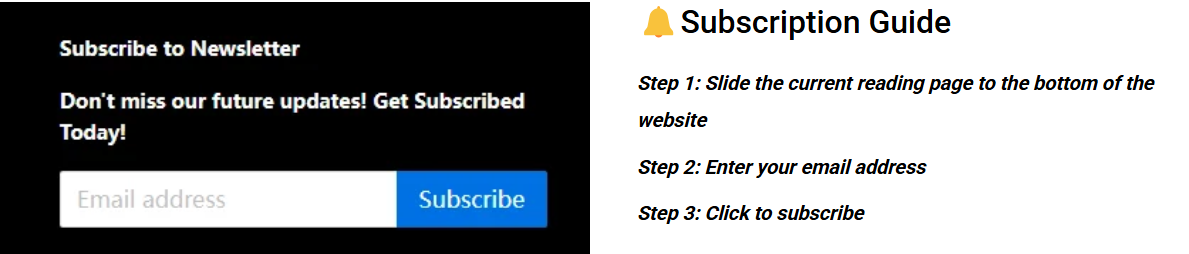
La mission première d' un prototype de dispositif médical, qui consiste à garantir la conformité réglementaire, diffère fondamentalement de celle d'un prototype d'ingénierie classique. C'est d'ailleurs la source des idées reçues concernant la lenteur des itérations. Dans le modèle traditionnel, la vérification fonctionnelle et la vérification réglementaire sont dissociées ; par conséquent, face à des défis réglementaires tels que la biocompatibilité et la sécurité électrique, des modifications importantes doivent être apportées ultérieurement au prototype, ce qui retarde considérablement les essais cliniques et l'homologation.
La stratégie de « prototypage axé sur l'enregistrement » de LS Manufacturing intègre systématiquement les exigences réglementaires dès la conception. Elle place les normes au cœur de ses priorités afin de garantir le respect des éléments clés de l'enregistrement, parallèlement à la réalisation fonctionnelle du prototype. Ce dernier est ainsi qualifié pour la validation clinique et les essais d'enregistrement, assurant le succès du lancement du produit dès la première tentative. Pour vous faire gagner du temps, voici un bref aperçu des principaux résultats.
Guide de référence rapide pour le prototypage de dispositifs médicaux
| Module | Points clés à retenir |
| Concept de base | Créer des « prototypes à enregistrement » qui intègrent la fonctionnalité et la conformité réglementaire. |
| Points de douleur traditionnels | L'introduction tardive d'exigences réglementaires dans le processus entraîne des modifications répétées du prototype, retardant ainsi sa mise sur le marché. |
| Éléments clés | La biocompatibilité, l'ingénierie de l'utilisabilité et la gestion des risques doivent être abordées simultanément lors de la phase de prototypage. |
| Solution | Concevoir le bon design dès le départ grâce à une surveillance réglementaire proactive et en travaillant en parallèle. |
| Valeur ultime | Réduire considérablement le risque d'homologation et raccourcir sensiblement le cycle total de lancement du produit. |
Le tableau suivant illustre comment accélérer le développement des dispositifs médicaux en modifiant les exigences réglementaires D'un « obstacle de dernière minute » à une « contribution à la conception en amont ». L'évolution vers une approche « axée sur l'enregistrement » signifie que le prototype lui-même deviendra la base de l'enregistrement, sans modifications perturbatrices ultérieures, dans le but d'un lancement sur le marché efficace, fiable et rapide.
Pourquoi faire confiance à ce guide ? L’expérience pratique des experts de LS Manufacturing
Des milliers d'articles en ligne traitent du prototypage de dispositifs médicaux ; alors pourquoi consacrer du temps à celui-ci ? Ce que nous partageons ici ne provient pas d'une définition théorique, mais plutôt de lignes directrices pratiques, conformes aux exigences rigoureuses des normes ISO 13485 et ISO 9001 et validées par d'innombrables interventions chirurgicales et résultats d'essais.
Depuis plus de dix ans, notre équipe a fabriqué plus de 50 000 prototypes sur mesure conformes aux exigences de la norme ISO 13485 relative aux dispositifs médicaux . Chaque projet nous a permis d’approfondir notre compréhension du paramétrage optimal des alliages de magnésium biodégradables sans les endommager thermiquement, du maintien de la stabilité des structures à parois minces lors du micro-fraisage et de la mise en œuvre simultanée des exigences de gestion des risques et d’ingénierie de l’ergonomie à chaque étape du processus.
Croyez-nous, la méthodologie que vous lisez ici est celle que nous utilisons au quotidien pour relever les défis. Travaillons ensemble pour transformer vos idées novatrices en produits fiables et performants.

Figure 1 : Prototype complet pour la vérification fonctionnelle par LS Manufacturing
Pourquoi les prototypes de dispositifs médicaux devraient-ils aller au-delà de la simple « validation fonctionnelle » ?
L'objectif ultime d'un prototype de dispositif médical n'est pas seulement de constituer un modèle fonctionnel, mais un prototype de produit capable de réussir toutes les procédures d'enregistrement et d'homologation rigoureuses et d'être appliqué en toute sécurité sur le corps humain. Par conséquent, sa validation doit couvrir l'intégralité du cycle de vie et les risques liés à son utilisation.
- Tolérance à la stérilité : Un prototype peut présenter un fonctionnement moteur parfait, mais ne pas supporter des processus de stérilisation répétés, tels que les hautes températures et pressions, l’irradiation ou l’immersion chimique . Le vieillissement des matériaux peut dégrader ses performances et provoquer des infections. Il est donc impératif de sélectionner et de valider des matériaux conformes dès la phase de prototypage .
- Aperçu de la biocompatibilité : Les pièces en contact direct ou indirect avec les patients doivent être fabriquées à partir de matériaux non toxiques et non allergènes . Le remplacement de ces matériaux par des matériaux biocompatibles ultérieurement dans le processus de conception peut affecter leurs propriétés mécaniques et nécessiter une refonte structurelle complète.
- Sécurité et CEM (Compatibilité Électromagnétique) : Pour les dispositifs actifs, les prototypes doivent prendre en compte, dès le départ, l’isolation électrique, le courant de fuite et autres indicateurs de sécurité afin d’éviter, en fonctionnement, toute interférence avec d’autres équipements, sans pour autant être eux-mêmes affectés par des perturbations externes. Toute correction ultérieure engendre des coûts exorbitants, une contrainte incontournable lors de l’homologation et des tests.
L'intégration des exigences de conformité réglementaire dès la conception des prototypes de dispositifs médicaux constitue une approche proactive de gestion des risques. Elle permet d'éviter des modifications de conception importantes dues à des problèmes de fonctionnalité survenant lors de l'enregistrement, des tests ou de la validation clinique, ce qui représente un gain de temps et d'argent considérable et constitue un élément fondamental pour accélérer la mise sur le marché du produit .
png" alt="Obtenir un devis" width="122" height="133">
Quel est l'impact de la certification ISO 13485 sur le système qualité pour le développement de prototypes ?
Le prototype ISO 13485 transforme le processus, potentiellement aléatoire, en un processus contrôlé, traçable et essentiel, garantissant dès le départ la sécurité et l'efficacité du produit final. Il exige un système qualité robuste dès la phase de conception. Cela se traduit notamment par :
Contrôles stricts de la conception et gestion de la documentation
Pour le prototypage, la documentation des données d'entrée, de sortie, de révision et de modification de la conception, conformément à la norme ISO 13485, est requise. Des spécifications complètes sont nécessaires, depuis les exigences du client jusqu'aux historiques de révision des plans et aux conclusions des revues de conception. Ceci garantit la cohérence entre le prototype et la conception initiale et constitue un historique de conception utile, fournissant des preuves directes pour les demandes d'enregistrement ultérieures.
Fabrication contrôlée et traçabilité
Cette norme exige la vérification et le contrôle des principaux processus de prototypage. Par exemple, concernant les matériaux de qualité médicale utilisés, les certificats de qualification des fournisseurs et les rapports d'inspection à réception doivent être fournis ; elle implique également la configuration et la validation des paramètres des équipements de traitement, tels que l'épaisseur de couche et la puissance du laser en impression 3D . Ceci permettrait de garantir La cohérence et la reproductibilité de ce processus de prototypage offrent une base solide pour les réplications ou itérations futures.
Intégration précoce de la gestion des risques
Les activités de gestion des risques doivent débuter suffisamment tôt lors du prototypage afin d'identifier les risques potentiels liés à la conception, aux matériaux et aux procédés, et de mettre en œuvre des mesures de contrôle. Ainsi, l'équipe est incitée à anticiper les exigences de sécurité, telles que le nettoyage, la stérilisation et la biocompatibilité , et à intégrer les solutions dès la conception et la fabrication du prototype , réduisant ainsi le risque de modifications majeures ultérieures.
La valeur ajoutée d'un système qualité tout au long du processus de prototypage va bien au-delà de la simple obtention d'une certification ISO 13485. Ce système permettra de créer, pour le prototype lui-même, un cadre standardisé et transparent ; non seulement un « échantillon » fonctionnel, mais un « pré-produit » fiable, complet en termes de données et dont les risques sont maîtrisés.
Sélection de matériaux de qualité médicale répondant aux exigences de biocompatibilité ?
Le choix du matériau constitue la première étape pour déterminer la biocompatibilité et la sécurité du produit lors du développement d'un prototype de dispositif médical . Le choix d'un matériau approprié minimise les risques liés à l'homologation, mais surtout, il garantit la sécurité du patient. Afin d'éclairer les critères de sélection, les principaux éléments à prendre en compte sont comparés ci-dessous.
| Dimensions de la considération | Parcours de base : Sélection de matériaux certifiés | Parcours avancé : Évaluation biologique des matériaux |
| Principe | L’utilisation de matériaux de qualité médicale bénéficiant d’une certification éprouvée, comme l’USP Classe VI ou l’ISO 10993, est primordiale. | Si un matériau innovant est utilisé, une évaluation biologique complète selon les normes ISO 10993 sera requise. |
Scénarios applicables | S'applique à la plupart des matériaux matures à faible risque et disposant d'une voie d'acheminement claire et rapide. | S'applique aux matériaux nouveaux et innovants ou aux scénarios d'interaction humaine totalement inédits présentant un risque et un coût plus élevés. |
| Preuves clés | Certificats de certification et rapports d'essais dûment remplis, fournis par le fournisseur de matériaux. | Mise en service d'un laboratoire correctement équipé et qualifié pour réaliser l'ensemble ou une partie des tests de sécurité requis. |
| Notre soutien | Nous proposons un service de mise en relation rapide et des recommandations basées sur une base de données validée de matériaux de qualité médicale , ainsi que des conseils sur les schémas d'évaluation et un soutien aux tests. | Nous accompagnons nos clients dans la réduction des risques de non-conformité tout au long du processus. |
Nous recommandons vivement d'intégrer la biocompatibilité dès les premières étapes du prototypage et de sélectionner des matériaux pré-certifiés issus de bases de données validées afin de minimiser les incertitudes . Lorsque des besoins innovants doivent être couverts, l'évaluation biologique complète sera planifiée longtemps à l'avance. Ceci permettra d'éviter les retards d'homologation et les perturbations de conception dues à des problèmes de matériaux dès le départ, et de garantir la sécurité et la mise sur le marché rapide des produits.

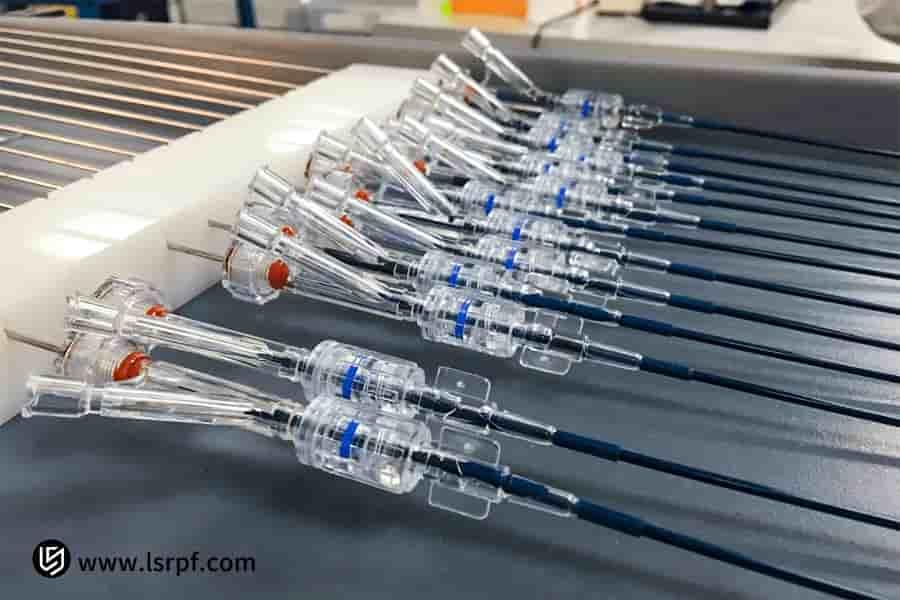
Figure 2 : Contrôle volumétrique précis pour les prototypes médicaux par LS Manufacturing
Quelles normes les prototypes aux différents stades cliniques doivent-ils respecter ?
La plupart des gens confondent le prototypage de dispositifs médicaux avec une activité où une seule version d'un prototype tente de répondre à tous les besoins. Il en résulte souvent un gaspillage de ressources ou un manque de normes. Or, la science préconise précisément, à chaque étape – du concept à la validation clinique –, la création de prototypes « optimaux », adaptés aux objectifs des différentes phases cliniques.
| Stade clinique | Objectifs principaux du prototype | Normes et stratégies de production |
| Preuve de concept | Vérifiez la faisabilité du concept dès que possible. | Des méthodes économiques et rapides, comme l'impression 3D, peuvent permettre de réaliser des fonctions essentielles. Les matériaux sont illimités ; le moment est venu d'itérer rapidement. |
| Tests fonctionnels | Effectuer des tests d'ingénierie complets sur les prototypes. | Validation approfondie des performances et de la fiabilité du produit à l'aide de prototypes qui représentent fidèlement la taille, les matériaux et les performances du produit. |
| Expérimentation animale | La première étape de la procédure consiste à évaluer la sécurité du produit en question et sa biocompatibilité . | Il doit être préparé à partir de matériaux biocompatibles de qualité médicale et après un traitement aseptique afin que les tests soient valides. |
| Validation clinique | Les données de sécurité et d'efficacité doivent être obtenues lors d'essais menés sur des humains. | Le prototype doit être représentatif du produit final et doit être conforme aux normes relatives aux dispositifs médicaux en ce qui concerne les performances, les matériaux et les procédés de fabrication. |
De manière générale, le prototypage de dispositifs médicaux est efficace grâce à une approche dynamique et progressive. De la phase de validation de principe économique jusqu'à la phase de quasi-commercialisation , incluant la validation clinique , chaque étape de la conception du prototype doit définir des objectifs précis assortis de normes adéquates. Cette stratégie permet de maîtriser les coûts de R&D en phase initiale tout en garantissant l' intégrité et la fiabilité de la chaîne de données du prototype , évitant ainsi les retards ou les échecs de projet dus à des normes de prototype non conformes.
Comment concilier précision et fabricabilité dans le prototype d'instruments chirurgicaux ?
Lors du développement de prototypes d'instruments chirurgicaux , l'objectif est non seulement d'améliorer la précision fonctionnelle, mais aussi de démontrer que leur conception peut être transposée de manière stable et économique en produits conformes aux normes de fabrication pour une production en série. Les principes de conception en vue de la fabrication doivent être privilégiés. Par conséquent, les points suivants doivent être pris en compte :
Simplification structurelle et optimisation de l'assemblage
Tout en garantissant la fonctionnalité, il convient de minimiser le nombre de pièces et d'éviter les structures internes complexes. Par exemple, l'impression 3D intégrée pourrait remplacer les structures d'assemblage traditionnelles composées de plusieurs pièces, ou des systèmes d'emboîtement autobloquants pourraient être adoptés à la place des fixations par vis. Ainsi, la difficulté et le temps d'assemblage ultérieurs seraient considérablement réduits, améliorant de ce fait l'efficacité et la régularité de la production.
Conception des procédés de fabrication et des tolérances
Lors du prototypage, il convient de prendre en compte les procédés de production en série, tels que le moulage par injection de précision et l'usinage 5 axes , et de définir des tolérances raisonnables. Il n'est pas nécessaire de rechercher une précision extrême si les dimensions d'assemblage ne sont pas critiques ; dans le cas contraire, le coût de fabrication augmentera considérablement. Les concepteurs doivent comprendre les limites de chaque procédé et prévoir des marges de sécurité pour les erreurs de fabrication, tout en respectant les exigences cliniques.
Faisabilité de la production en série de matériaux et de traitements de surface
Le choix des matériaux pour un prototype doit répondre aux exigences de biocompatibilité et de propriétés mécaniques, tout en tenant compte de la stabilité de la chaîne d'approvisionnement et du coût de production en série. Par ailleurs, les traitements de surface spécifiques, tels que les revêtements antibactériens, doivent pouvoir être appliqués de manière stable et uniforme sur des lots de pièces, et non sur des échantillons de laboratoire.
Un prototype réussi d'instrument chirurgical intègre les contraintes de fabrication dès sa conception. Il identifie et optimise les problèmes potentiels de fabrication, de qualité et de coût en vue d'une production à grande échelle . L'objectif est d'éviter de concevoir un produit « parfait », soit irréalisable, soit trop coûteux à produire, et de garantir une transition fluide du prototype à la production de masse.
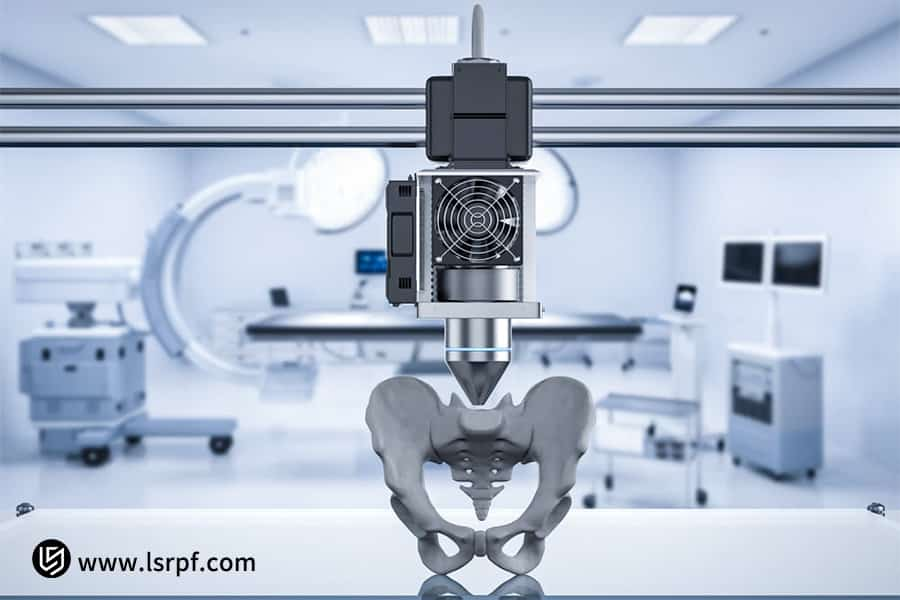
Figure 3 : Développement accéléré d'implants chirurgicaux sur mesure par LS Manufacturing
Comment la technologie de prototypage rapide facilite-t-elle l'innovation dans le domaine des dispositifs médicaux ?
L'atout majeur du prototypage rapide pour les dispositifs médicaux réside dans sa capacité à raccourcir le délai entre la conception et la validation physique, offrant ainsi une plateforme idéale pour les essais, les erreurs et l'itération. Parmi ces technologies, l'impression 3D de qualité médicale joue un rôle révolutionnaire, ses avantages et ses exigences se reflétant notamment dans :
- Réalisation de structures complexes et personnalisation : Les microcanaux complexes et les structures osseuses trabéculaires poreuses, difficiles à réaliser par les méthodes traditionnelles, peuvent être facilement produits grâce à l’impression 3D de qualité médicale . Des guides chirurgicaux et des implants personnalisés peuvent ainsi être fabriqués pour s’adapter parfaitement à l’anatomie du patient, une avancée qui contribue directement à la médecine de précision.
- Intégration de plusieurs matériaux et fonctions : Ces technologies modernes de prototypage rapide permettent de fabriquer des composants à partir d’une gamme de matériaux variés, allant des matériaux rigides et flexibles aux matériaux biodégradables, le tout au sein d’un seul composant. Par exemple, un composant intégré combinant une structure rigide et un joint souple peut être imprimé en une seule étape pour être utilisé dans des modèles anatomiques simulant des organes réels ou dans des prototypes de dispositifs complexes d’administration de médicaments.
- Répondre aux exigences spécifiques des applications médicales : la sécurité et la conformité ne doivent jamais être sacrifiées lors du prototypage rapide de dispositifs médicaux , quelles que soient les circonstances.Les matériaux doivent être biocompatibles et le processus d'impression lui-même doit être validé de manière à garantir la cohérence d'un lot à l'autre et la traçabilité tout au long du processus , conformément aux exigences du système qualité .
Il s'agit d'une catégorie de technologies de prototypage rapide où l'impression 3D de qualité médicale permet aux équipes de R&D d'explorer des conceptions auparavant impossibles à moindre coût et en un temps record. Le contrôle rigoureux des matériaux et du processus garantit que l'innovation respecte la réglementation en vigueur depuis les étapes initiales jusqu'à la validation clinique et l'enregistrement du produit.
Comment LS Manufacturing aide-t-elle les instruments chirurgicaux mini-invasifs à surmonter les obstacles technologiques ?
La valeur ajoutée de notre offre en matière de R&D de dispositifs médicaux innovants réside dans nos services de prototypage, qui permettent à nos clients de surmonter les principaux obstacles technologiques au lancement de leurs produits. L' exemple suivant illustre l'application de l' approche de prototypage médical de LS Manufacturing :
Défi du client
Lors du développement d'un nouveau type d' instrument chirurgical mini-invasif – un dispositif d'anastomose intracavitaire – une entreprise innovante s'est heurtée à d'importants obstacles lors des tests sur les animaux. Le mécanisme de transmission principal présentait un temps de latence significatif et ne permettait pas aux chirurgiens de contrôler efficacement et précisément l'anastomose. De plus, les contraintes liées au procédé de fabrication traditionnel, dues à la complexité de sa structure interne, ne permettaient plus d'optimisation.
Solution de fabrication LS
Notre équipe d'ingénierie est intervenue immédiatement, abandonnant la méthode d'usinage traditionnelle. Nous avons utilisé la technologie d'impression 3D en acier inoxydable de qualité médicale , fabriquant un système de transmission monobloc et en une seule étape, offrant un chemin mécanique optimisé et un jeu minimal. Ce procédé a non seulement résolu le problème de latence, mais a également permis d'améliorer encore la qualité de cette cavité moulée monobloc complexe, grâce à un électropolissage. Ce procédé confère à la cavité un état de surface nettement supérieur aux normes et répond parfaitement aux exigences extrêmement élevées de stérilité et de propreté requises pour les instruments chirurgicaux.
Résultats et valeur
Lors des essais ultérieurs sur animaux, le prototype nouvellement fabriqué a fonctionné parfaitement, et la rapidité et la précision de la réponse opérationnelle de l'instrument se sont améliorées d'environ 60 % , ce qui lui a valu les éloges des experts cliniques. Cette avancée technologique a ainsi permis d'avancer le calendrier global du projet du client d'au moins 5 mois et d'économiser plus de 2 millions de RMB en coûts de R&D liés aux essais et erreurs répétés et aux modifications du moule.
Nous avons mis en œuvre des technologies de pointe, comme l'impression 3D de qualité médicale, afin de surmonter les limitations structurelles, matérielles et de performance courantes des instruments chirurgicaux mini-invasifs pour nos clients. Ce qui semblait être des défis techniques insurmontables est devenu un atout concurrentiel majeur, leur permettant de gagner un temps précieux sur le marché et de réaliser d'importants bénéfices en termes de coûts.

Figure 4 : Dosage de précision dans la fabrication de prototypes médicaux par LS Manufacturing
Quel type de documentation technique est requis pour le développement de prototypes de dispositifs médicaux ?
La documentation technique complète est la pierre angulaire d'une procédure d'enregistrement réussie pour les dispositifs médicaux. Elle sert principalement à documenter de manière exhaustive le processus de maîtrise de la conception et à fournir des preuves de la sécurité et de l'efficacité du produit. Elle constitue non seulement une feuille de route pour le développement interne, mais elle atteste également auprès des autorités réglementaires de la capacité de l'entreprise à mener un développement systématique et conforme. Elle comprend notamment les documents clés suivants :
- Documents d'entrée et de sortie de conception : Il s'agit du point de départ du système de documentation : les données d'entrée de conception doivent consigner clairement les besoins des utilisateurs, les fonctions cliniques, les indicateurs de performance et les normes réglementaires. Les données de sortie de conception comprennent les plans du produit, les spécifications techniques, les nomenclatures, etc. Chaque donnée d'entrée doit être vérifiée afin de garantir l'existence d'une donnée de sortie correspondante.
- Documentation relative à la certification des matériaux et à la biocompatibilité : Les certifications des fournisseurs et les certificats de conformité de tous les matériaux de qualité médicale, ainsi que les rapports d’évaluation ou d’essais de biocompatibilité pertinents aux exigences de la classe VI de l’USP ou de la norme ISO 10993, doivent être disponibles. Ces éléments permettent d’établir la biocompatibilité du produit.
- Documents de validation du processus de fabrication : Démontrer que le processus de fabrication du prototype est cohérent et contrôlable pour chaque processus critique impliqué dans sa création, tels que les paramètres d’impression 3D ou les processus de stérilisation , au moyen de dossiers détaillés sur les paramètres du processus, de certificats d’étalonnage des équipements et de rapports d’inspection du premier article.
En d'autres termes, la création d' une documentation technique, en tant qu'activité fondamentale menée en parallèle du prototypage, garantit le bon déroulement du projet ; il ne s'agit pas d'une simple formalité. Un système de documentation de contrôle de conception efficace, tel le « certificat de naissance » du produit, retrace clairement le parcours de conception, du concept initial au prototype.
Comment planifier le parcours de la demande d'inscription pendant la phase de prototypage ?
Grâce à une préparation rigoureuse du dossier d'enregistrement , le développement accéléré des dispositifs médicaux peut être assuré. Dans ce processus, chaque donnée générée constitue un élément essentiel pour les futurs documents d'enregistrement. Autrement dit, les trois niveaux suivants doivent être planifiés de manière systématique :
Définition claire des exigences relatives aux preuves d'inscription
La phase de conception du prototype exige une analyse approfondie des exigences réglementaires du marché cible. Les principaux points à vérifier lors de l'examen des enregistrements, tels que les indicateurs de performance, la biocompatibilité et la sécurité électrique, sont traduits en paramètres techniques précis que le prototype devra valider. Ceci garantit, dès le départ, le développement d'un prototype conforme à la réglementation.
Transformer les données de validation du prototype en preuves d'enregistrement
Le prototype devra faire l'objet de tests fonctionnels, de durée de vie et d'utilisabilité conformes aux exigences du système qualité . Tous les tests devront être réalisés selon un protocole standard préalablement approuvé, comprenant un enregistrement complet des données brutes et un rapport standardisé.Il s'agira de données hautement contrôlées qui pourront ensuite être directement soumises comme preuve essentielle pour la validation future de la conception, évitant ainsi des tests répétés.
Mettre en place un système transparent de documentation de l'historique de conception
Ce système doit fournir un compte rendu complet du processus, depuis la conception initiale jusqu'à la version finale, en passant par les modifications. Ce système de documentation, qui se met naturellement en place dans le cadre du contrôle de la conception, constitue la meilleure preuve à apporter aux organismes de réglementation quant à la rigueur et à la maîtrise du processus de conception, ce qui peut considérablement améliorer l'efficacité et le taux de réussite des examens d'homologation.
En d'autres termes, l'intégration de la demande d'enregistrement dès la phase de prototypage constitue le meilleur levier pour accélérer le développement des dispositifs médicaux . Elle permet en effet de réduire considérablement les coûts et les délais importants liés aux données d'enregistrement supplémentaires rencontrés lors des phases ultérieures du projet, tout en améliorant la standardisation et le taux de réussite de l'ensemble du processus de R&D dès le départ. Ceci jette les bases d'une commercialisation rapide et stable des produits.
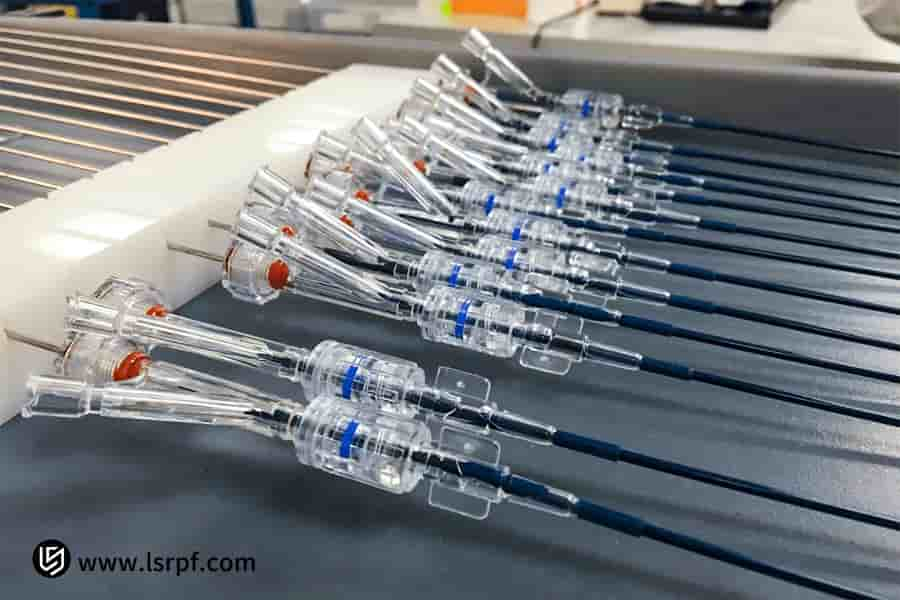
Figure 5 : Prototype à 360 degrés pour la validation fonctionnelle par LS Manufacturing
FAQ
1. Quelles sont les exigences spécifiques à respecter lors du développement de prototypes de dispositifs médicaux ?
Par ailleurs, au-delà des fonctionnalités de base, il est essentiel d'anticiper le respect des normes spécifiques aux dispositifs médicaux. Nous appliquons rigoureusement le système qualité ISO 13485 afin de garantir que ces prototypes répondent aux exigences réglementaires en matière de biocompatibilité, de tolérance à la stérilisation, de sécurité électrique et autres aspects, dès le début de leur procédure d'enregistrement.
2. Combien de temps faut-il pour passer du concept à l'obtention du premier prototype fonctionnel ?
Cela dépend de la complexité du dispositif. Les dispositifs relativement simples sont livrés en 2 à 3 semaines, tandis que les plus complexes, avec des transmissions de précision et des composants électroniques, nécessitent 4 à 6 semaines . Nous disposons d'un service express pour répondre rapidement à vos besoins urgents en R&D et garantir pleinement le respect de vos délais.
3. Est-il possible de fabriquer de petits lots de dispositifs pour essais cliniques ?
Bien entendu, nous proposons également la fabrication de petits lots de dispositifs pour essais cliniques , de 10 à 100 unités . La fabrication est réalisée conformément aux normes de fabrication des dispositifs médicaux , et chaque unité est conçue pour répondre aux exigences strictes de performance, de qualité et de constance des essais cliniques.
4. Comment assurez-vous la biocompatibilité des matériaux prototypes ?
Nous maîtrisons les risques à la source grâce à une sélection rigoureuse de matériaux de qualité médicale, certifiés selon des normes reconnues telles que l'ISO 10993 ou l'USP Classe VI. Les documents de certification complets peuvent être fournis avec le prototype, constituant ainsi une preuve tangible pour votre évaluation de biocompatibilité.
5. Comment protégez-vous notre propriété intellectuelle pendant le processus de prototypage ?
La sécurité des informations est primordiale pour nous. Chaque projet débute par un accord de confidentialité juridiquement contraignant et, en interne, nous appliquons un système rigoureux de gestion de la hiérarchie des données et de contrôle d'accès.À la demande du client, des pare-feu physiques et informatiques peuvent également être mis en place.
6. Quels types de prototypes de dispositifs médicaux soutenez-vous ?
Les services proposés par notre entreprise couvrent un large éventail de dispositifs, allant des équipements actifs (comme les appareils de diagnostic) aux dispositifs passifs (instruments chirurgicaux, implants et dispositifs non implantables ). LS Manufacturing maîtrise parfaitement les réglementations et les procédures relatives aux différents produits.
7. Comment rendre les données du prototype disponibles pour être utilisées dans les demandes d'enregistrement ultérieures ?
Outre les prototypes, nous fournissons un dossier complet de preuves de qualité, comprenant des enregistrements de production détaillés, des rapports d'inspection des processus et des données d'essais de performance . Tous ces éléments sont conformes aux spécifications et peuvent être utilisés directement comme matériel de vérification de conception pour appuyer les demandes d'enregistrement.
8. Comment démarrer un projet de prototype de dispositif médical ?
Le processus de démarrage est assez simple : il vous suffit de remplir quelques croquis conceptuels initiaux ou vos exigences techniques, et nous veillerons à ce qu’un ingénieur senior prenne contact avec vous dans un délai d’un jour ouvrable pour discuter en détail des solutions techniques et vous fournir une première évaluation de projet ainsi qu’un devis.
Résumé
Les prototypes de dispositifs médicaux représentent bien plus qu'une simple réalisation technique ; ils constituent la pierre angulaire de la gestion des risques, de la conformité réglementaire et du succès commercial. Choisir le bon partenaire de prototypage est essentiel pour assurer la réussite de l'ensemble du cycle de vie du produit.
Par conséquent, si vous souhaitez accélérer votre R&D tout en réduisant les risques liés à l'homologation, contactez dès aujourd'hui nos experts en dispositifs médicaux pour une solution de prototypage optimisée pour l'homologation adaptée à votre projet ! Laissez-nous mettre notre expertise en fabrication de dispositifs médicaux à votre service pour sécuriser votre parcours d'innovation.
📞Téléphone : +86 185 6675 9667
📧 Courriel : info@longshengmfg.com
🌐Site web : https://lsrpf.com/
Clause de non-responsabilité
Le contenu de cette page est fourni à titre informatif uniquement. LS Manufacturing ne fait aucune déclaration ni ne donne aucune garantie, expresse ou implicite, quant à l'exactitude, l'exhaustivité ou la validité des informations. Il ne faut pas en déduire que les fournisseurs ou fabricants tiers fourniront, par l'intermédiaire du réseau LS Manufacturing, les paramètres de performance, les tolérances géométriques, les caractéristiques de conception spécifiques, la qualité et le type des matériaux, ou les procédés. L'acheteur est seul responsable de ces informations. Pour obtenir un devis pour des pièces, veuillez préciser les exigences exactes concernant ces pièces. Veuillez nous contacter pour plus d'informations .
Équipe de fabrication LS
LS Manufacturing est une entreprise leader du secteur, spécialisée dans les solutions de fabrication sur mesure. Forte de plus de 20 ans d'expérience au service de plus de 5 000 clients, elle se concentre sur l'usinage CNC de haute précision, la fabrication de tôlerie , l'impression 3D , le moulage par injection , l'emboutissage de métaux et d'autres services de fabrication intégrés.
Notre usine dispose de plus de 100 centres d'usinage cinq axes ultramodernes et est certifiée ISO 9001:2015.Nous proposons des solutions de fabrication rapides, efficaces et de haute qualité à nos clients dans plus de 150 pays et régions du monde. Qu'il s'agisse de petites séries ou de productions sur mesure, nous répondons à vos besoins sous 24 heures. Choisir LS Manufacturing, c'est choisir l'efficacité, la qualité et le professionnalisme.
Pour plus d'informations, veuillez consulter notre site web : www.lsrpf.com .