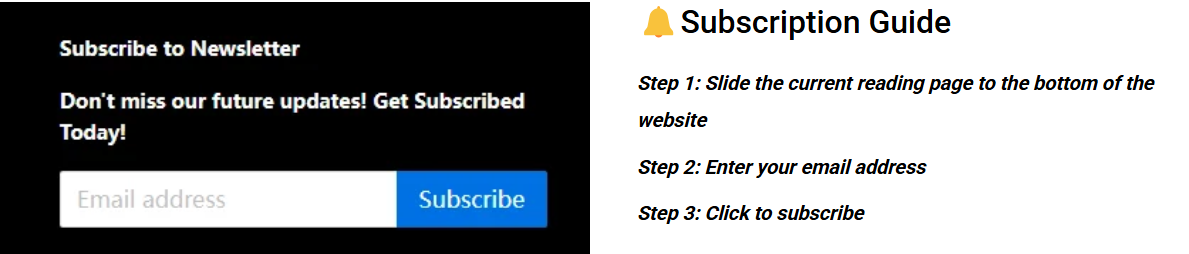
La missione principale del prototipo di dispositivo medico , ovvero garantire la conformità normativa, è fondamentalmente diversa da quella dei prototipi ingegneristici generali. In realtà, questa è la causa principale di idee sbagliate sulla lentezza dell'iterazione. Nel modello tradizionale, la verifica funzionale è separata da quella normativa; pertanto, quando si affrontano sfide normative come la biocompatibilità e la sicurezza elettrica, è necessario apportare modifiche drastiche al prototipo in un secondo momento, ritardando enormemente gli studi clinici e la registrazione.
La strategia di " Registration-Oriented Prototyping " di LS Manufacturing integra i requisiti normativi in modo sistematico fin dalla fase di progettazione. Pone gli standard in cima alla lista delle priorità per garantire il rispetto degli elementi chiave di registrazione in concomitanza con la realizzazione funzionale del prototipo, in modo che quest'ultimo sia idoneo per la validazione clinica e i test di registrazione, garantendo così il successo del lancio del prodotto al primo tentativo. Per farvi risparmiare tempo, ecco una breve panoramica dei principali risultati.
Guida rapida alla prototipazione di dispositivi medici
| Modulo | Conclusione chiave |
| Concetto fondamentale | Creare " prototipi orientati alla registrazione " che integrino la funzionalità con la conformità normativa. |
| Punti dolenti tradizionali | L'introduzione di requisiti normativi in una fase avanzata del processo comporta ripetute modifiche al prototipo, ritardando il time-to-market. |
| Elementi chiave | Nella fase di prototipazione , la biocompatibilità, l'ingegneria dell'usabilità e la gestione del rischio devono essere affrontate tutte insieme. |
| Soluzione | Ottieni il design giusto fin dal primo momento attraverso una supervisione normativa proattiva e lavorando in parallelo. |
| Valore ultimo | Riducendo drasticamente il rischio di registrazione e accorciando sostanzialmente il ciclo complessivo di lancio del prodotto. |
La tabella seguente illustra come accelerare lo sviluppo dei dispositivi medici spostando i requisiti normativi da "ostacolo in fase avanzata" a "input di progettazione in fase iniziale". Il passaggio a un approccio "orientato alla registrazione" implica che il prototipo stesso diventerà la base per la registrazione, senza modifiche dirompenti in seguito, con l'obiettivo di un lancio sul mercato efficiente, affidabile e rapido.
Perché fidarsi di questa guida? Esperienza pratica degli esperti di LS Manufacturing
Esistono diverse migliaia di articoli online sull'argomento della prototipazione di dispositivi medici: perché perdere tempo leggendo questo? Ciò che condividiamo qui non deriva da una definizione da manuale, ma piuttosto da alcune linee guida pratiche, vincolate ai rigorosi vincoli dei sistemi ISO 13485 e ISO 9001 e convalidate da innumerevoli interventi chirurgici e risultati di test.
Per oltre un decennio, il nostro team ha realizzato più di 50.000 prototipi personalizzati conformi ai requisiti del sistema di qualità ISO 13485 per i dispositivi medici . Ogni progetto ci ha permesso di comprendere meglio come impostare i parametri di taglio per leghe di magnesio biodegradabili senza danni termici, come mantenere la stabilità in strutture a pareti sottili durante la microfresatura e come implementare simultaneamente i requisiti di gestione del rischio e di ingegneria dell'usabilità in ogni fase dell'iterazione.
Fidatevi di noi, quello che leggete qui è la metodologia fondamentale che utilizziamo quotidianamente per superare le sfide. Lavoriamo insieme per trasformare le vostre idee innovative con efficienza e affidabilità in prodotti affidabili.

Figura 1: Prototipo completo per la verifica della funzionalità da parte di LS Manufacturing
Perché i prototipi dei dispositivi medici dovrebbero andare oltre la "validazione funzionale"?
L'obiettivo finale del prototipo di dispositivo medico non è quello di essere semplicemente un modello "funzionante", ma un " prototipo di prodotto " in grado di superare tutti i rigorosi processi di registrazione e approvazione e di essere applicato in modo sicuro sul corpo umano. Pertanto, l'ambito della sua convalida deve includere l'intero ciclo di vita dei rischi d'uso.
- Tolleranza alla sterilità: un prototipo potrebbe avere una perfetta funzionalità motoria, ma potrebbe non sopportare ripetuti processi di sterilizzazione, come alte temperature e pressioni, irradiazione o immersione chimica . L'invecchiamento del materiale può degradarne le prestazioni e causare infezioni cliniche. I materiali conformi devono essere selezionati e convalidati durante la fase di prototipazione .
- Panoramica sulla biocompatibilità: le parti che entrano in contatto diretto o indiretto con i pazienti devono essere realizzate con materiali atossici e anallergici . La sostituzione con materiali biocompatibili in una fase successiva del processo di progettazione potrebbe comprometterne le proprietà meccaniche e richiedere una completa riprogettazione strutturale.
- Sicurezza e compatibilità elettromagnetica (EMC): nel caso di dispositivi attivi, i prototipi devono considerare in anticipo l'isolamento elettrico, la corrente di dispersione e altri indicatori di sicurezza per evitare, durante il funzionamento, di influenzare altre apparecchiature senza essere influenzati da interferenze esterne. La successiva rettifica ha un costo astronomico, e questa è una necessità da affrontare in fase di registrazione e collaudo.
Integrare i requisiti di conformità normativa nello sviluppo di prototipi di dispositivi medici è in realtà un approccio proattivo alla gestione del rischio. Ciò eviterebbe drastiche modifiche progettuali dovute a problemi di funzionalità che si presentano durante la registrazione e i test o la convalida clinica, con un notevole risparmio di tempo e denaro, e rappresenta la pietra angolare per accelerare il lancio del prodotto .
png" alt="Richiedi un preventivo" width="122" height="133">
In che modo la certificazione ISO 13485 influisce sul sistema di qualità per lo sviluppo di prototipi?
La norma ISO 13485 Prototype trasforma il processo da un'attività potenzialmente casuale a un processo controllato, tracciabile e vitale che fornisce una fiducia immediata nella sicurezza e nell'efficacia del prodotto finale. Richiede un solido sistema di qualità fin dalla fase di progettazione. Ciò si riflette in particolare in:
Rigorosi controlli di progettazione e gestione della documentazione
Per la prototipazione, è necessario disporre della documentazione di input, output, revisione e modifica del progetto secondo la norma ISO 13485. Sono richieste specifiche completamente documentate, dalle specifiche dei requisiti del cliente ai registri di revisione dei disegni, fino alle conclusioni della revisione del progetto. Ciò garantisce inoltre la coerenza tra il prototipo e l'intento progettuale e costituisce un'utile "cronologia del progetto", che fornisce una prova diretta per le successive domande di registrazione.
Produzione controllata e tracciabilità
Questo standard richiede la verifica e il controllo dei principali processi di prototipazione. Ad esempio, per quanto riguarda i materiali di grado medicale coinvolti, è necessario fornire certificati di qualificazione del fornitore e registri di ispezione in entrata ; prevede inoltre la configurazione e la conferma dei parametri delle apparecchiature di lavorazione, come lo spessore dello strato e la potenza del laser nella stampa 3D . Ciò garantirebbe coerenza e ripetibilità in questo processo di prototipazione e forniscono una base chiara per future repliche o iterazioni.
Integrazione precoce della gestione del rischio
Le attività di gestione del rischio dovrebbero iniziare con sufficiente anticipo durante la prototipazione per identificare i potenziali rischi associati a progettazione, materiali e processi per i quali è necessario implementare misure di controllo. A tal proposito, ciò obbliga il team a considerare in anticipo i requisiti legati alla sicurezza, come pulizia, sterilizzazione e biocompatibilità , e a integrare le soluzioni nella progettazione e nella produzione del prototipo , riducendo il rischio di modifiche progettuali sostanziali in seguito.
Il valore derivante da un sistema di qualità lungo l'intero processo di prototipazione va ben oltre il semplice ottenimento di una certificazione ISO 13485. Ciò produrrà, per il prototipo stesso, un quadro standardizzato e trasparente ; non solo un "campione" funzionale, ma un " pre-prodotto " affidabile, completo di dati e con rischi controllati.
Selezione di materiali di grado medico che soddisfano i requisiti di biocompatibilità?
La selezione è il primo ostacolo nella determinazione della biocompatibilità e della sicurezza del prodotto nello sviluppo del prototipo del dispositivo medico . La scelta di un materiale appropriato riduce al minimo i rischi in fase di registrazione, ma soprattutto garantisce la sicurezza del paziente. Per chiarire le logiche di selezione, di seguito vengono confrontate le considerazioni chiave.
| Dimensioni della considerazione | Percorso base: selezione dei materiali certificati | Percorso avanzato: valutazione biologica dei materiali |
| Principio | L'utilizzo di materiali di grado medico con certificazione consolidata è prioritario, come USP Classe VI o ISO 10993. | Se si utilizza un materiale innovativo, sarà richiesta una valutazione biologica completa secondo gli standard ISO 10993 . |
Scenari applicabili | Si applica alla maggior parte dei materiali maturi, a basso rischio e con un percorso chiaro e veloce. | Si applica a materiali nuovi e innovativi o a scenari di interazione uomo-uomo completamente nuovi, caratterizzati da rischi e costi più elevati. |
| Prove chiave | Certificati di certificazione e rapporti di prova completamente compilati dal fornitore del materiale. | Incaricare un laboratorio adeguatamente attrezzato e qualificato per eseguire l'intera serie o una parte dei test di sicurezza richiesti. |
| Il nostro supporto | Forniamo abbinamenti e raccomandazioni rapidi basati su un database convalidato di materiali di grado medico , insieme a consulenza su schemi di valutazione e supporto per i test. | Supportiamo i clienti nella mitigazione dei rischi di conformità lungo l'intero processo. |
Raccomandiamo vivamente di pianificare la biocompatibilità fin dalle prime fasi della prototipazione, selezionando materiali pre-certificati da database convalidati per ridurre al minimo l'incertezza . Laddove sia necessario soddisfare esigenze innovative, l'intero percorso di valutazione biologica sarà pianificato con largo anticipo. Ciò eviterebbe ritardi nella registrazione e interruzioni nella progettazione dovute a problemi relativi ai materiali fin dall'inizio, gettando le basi per la sicurezza e il rapido lancio sul mercato dei prodotti.

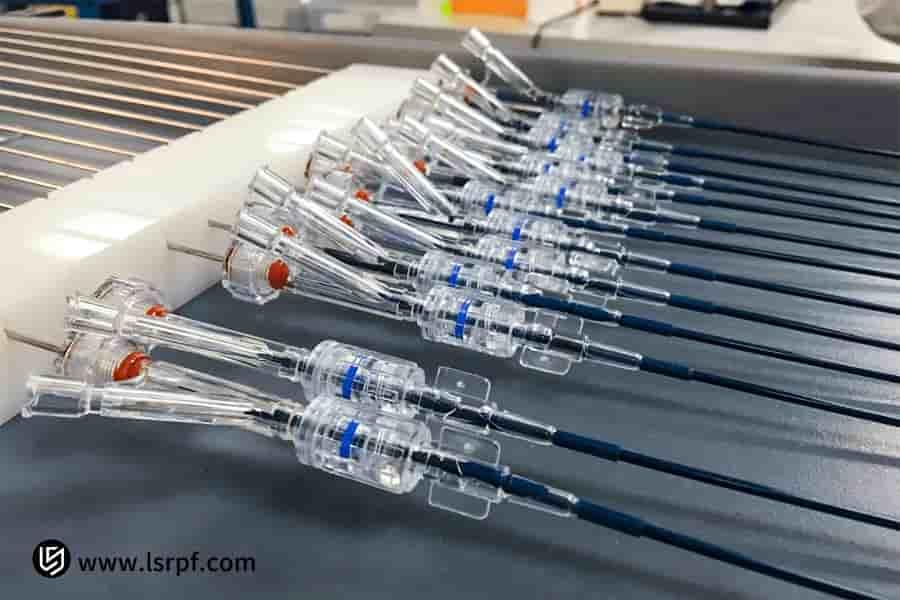
Figura 2: Controllo volumetrico accurato per prototipi medici di LS Manufacturing
Quali standard devono soddisfare i prototipi nelle diverse fasi cliniche?
La maggior parte delle persone interpreta erroneamente la prototipazione di dispositivi medici come un'attività in cui una versione di un prototipo cerca di soddisfare tutte le esigenze. Ciò si traduce spesso in uno spreco di risorse nell'utilizzo o nella mancanza di standard. Ciò che la scienza supporta precisamente in ogni fase, dall'ideazione alla convalida clinica , è la realizzazione di prototipi "perfetti", basati sugli obiettivi delle diverse fasi cliniche.
| Fase clinica | Obiettivi principali del prototipo | Standard e strategie di produzione |
| Prova di concetto | Verificare la fattibilità del concetto progettuale il prima possibile. | Metodi economici e rapidi, come la stampa 3D, possono realizzare funzioni fondamentali. I materiali sono illimitati; ora è il momento di una rapida iterazione. |
| Test funzionali | Eseguire test ingegneristici completi sui prototipi. | Validazione approfondita delle prestazioni e dell'affidabilità del prodotto mediante prototipi che rappresentano fedelmente le dimensioni, i materiali e le prestazioni del prodotto. |
| Sperimentazione sugli animali | Il primo passo della procedura è valutare la sicurezza del prodotto in questione e la sua biocompatibilità . | Affinché i test siano validi, deve essere preparato con materiale biocompatibile di grado medico, previa lavorazione asettica. |
| Validazione clinica | I dati sulla sicurezza e sull'efficacia devono essere ottenuti da studi condotti sugli esseri umani. | Il prototipo deve essere rappresentativo del prodotto finale e deve essere conforme alle norme sui dispositivi medici per quanto riguarda prestazioni, materiali e processi di produzione. |
In generale, la prototipazione di dispositivi medici funziona efficacemente con un approccio dinamico ma progressivo. Dalla fase "economica" di proof-of-concept fino alla fase di "quasi-commercializzazione" , con validazione clinica , ogni fase di progettazione del prototipo dovrebbe definire obiettivi specifici con standard coerenti. Una strategia di questo tipo consentirà di contenere efficacemente i costi di ricerca e sviluppo iniziali, garantendo al contempo l' integrità e l'affidabilità della catena dati del prototipo , evitando così ritardi o insuccessi del progetto dovuti a standard di prototipo non corrispondenti.
Come si possono bilanciare precisione e producibilità nel prototipo di strumenti chirurgici?
Nel processo di sviluppo di prototipi di strumenti chirurgici , l'obiettivo non è solo quello di ottenere una migliore precisione funzionale, ma anche di dimostrare che il loro design può essere trasformato in modo stabile ed economico in prodotti qualificati per la produzione in serie. I principi di progettazione per la producibilità dovrebbero essere considerati prioritari. Pertanto, è necessario tenere conto dei seguenti punti:
Semplificazione strutturale e ottimizzazione dell'assemblaggio
Pur garantendo la funzionalità, il numero di componenti dovrebbe essere ridotto al minimo ed evitate strutture interne complesse. Ad esempio, la tecnologia di stampa 3D integrata potrebbe essere utilizzata al posto delle tradizionali strutture di assemblaggio multicomponente, oppure si potrebbero adottare soluzioni a scatto autobloccanti al posto del fissaggio a vite. In questo modo, la difficoltà e i tempi di assemblaggio successivi potrebbero essere notevolmente ridotti, migliorando così l'efficienza e la coerenza della produzione.
Abbinamento dei processi di produzione e progettazione delle tolleranze
Nella fase di prototipazione, è necessario considerare i processi coinvolti nella produzione di massa, come lo stampaggio a iniezione di precisione e la lavorazione a 5 assi , e impostare tolleranze ragionevoli. Non è necessario perseguire una precisione estrema se le dimensioni di accoppiamento non sono critiche ; in caso contrario, i costi di lavorazione aumenteranno drasticamente. I progettisti devono comprendere i limiti di capacità dei diversi processi e lasciare margini ragionevoli per gli errori di produzione, soddisfacendo al contempo i requisiti clinici.
Fattibilità della produzione in serie di materiali e trattamenti superficiali
La selezione dei materiali nel caso di un prototipo dovrebbe soddisfare non solo i requisiti di biocompatibilità e proprietà meccaniche, ma anche considerare la stabilità della catena di fornitura e i costi di produzione in serie. Nel frattempo, trattamenti superficiali speciali, come il rivestimento antibatterico, dovrebbero poter essere applicati in modo stabile e uniforme su lotti di componenti piuttosto che su campioni di laboratorio.
Un prototipo di successo di uno strumento chirurgico tiene conto fin dall'inizio delle considerazioni di producibilità . Identifica e ottimizza possibili problemi di produzione, qualità e costi per la produzione su larga scala . L'idea è quella di evitare di progettare un prodotto "perfetto" che sia irrealizzabile o troppo costoso da realizzare, e anche di garantire che la transizione dal prototipo alla produzione di massa sia fluida.
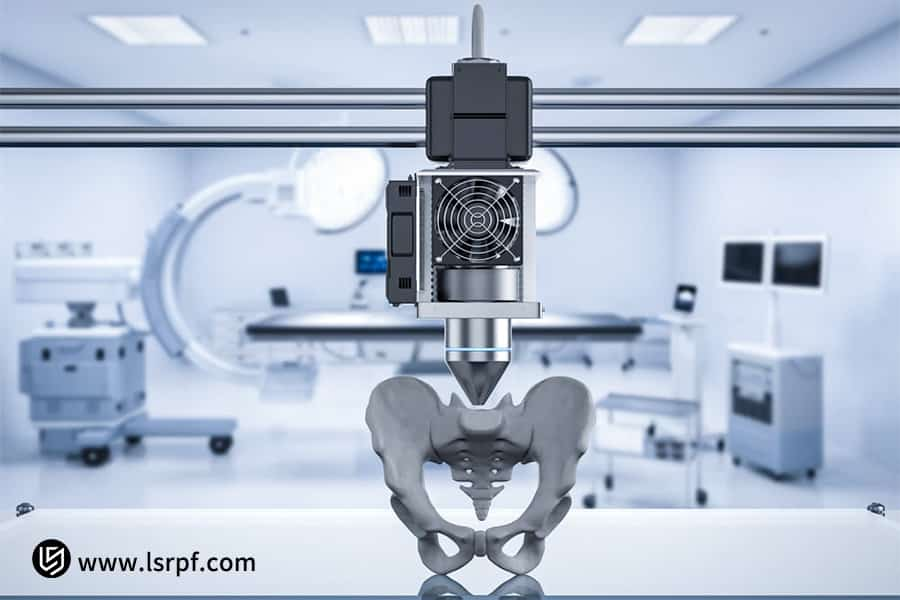
Figura 3: Sviluppo accelerato di impianti chirurgici su misura da parte di LS Manufacturing
In che modo la tecnologia di prototipazione rapida facilita l'innovazione nei dispositivi medici?
Il valore più importante della prototipazione rapida per i dispositivi medici è la possibilità di ridurre i tempi dalla progettazione concettuale alla verifica fisica, fornendo una piattaforma estremamente efficace per tentativi ed errori e iterazioni. Tra queste tecnologie, la stampa 3D di livello medicale sta svolgendo un ruolo rivoluzionario, con vantaggi e requisiti che si riflettono in particolare in:
- Ottenere strutture complesse e personalizzazione: microcanali complessi e strutture ossee trabecolari porose, difficili da elaborare con i metodi tradizionali, possono essere facilmente prodotti con la stampa 3D di livello medicale . Guide chirurgiche e impianti personalizzati possono quindi essere realizzati per adattarsi perfettamente all'anatomia del paziente, uno sviluppo che contribuisce direttamente alla medicina di precisione.
- Integrazione di diversi materiali e funzioni: queste moderne tecnologie di prototipazione rapida consentono di realizzare componenti con una gamma di materiali che spaziano da rigidi e flessibili a biodegradabili, il tutto all'interno di un unico componente. Ad esempio, un componente integrato che combina una struttura rigida con una guarnizione morbida può essere stampato in un unico passaggio per l'utilizzo in modelli anatomici che simulano organi reali o prototipi di dispositivi complessi per la somministrazione di farmaci.
- Soddisfare i requisiti specifici delle applicazioni mediche: sicurezza e conformità non possono mai essere sacrificate nella prototipazione rapida dei dispositivi medici , indipendentemente dalla velocità in gioco.I materiali devono essere biocompatibili e il processo di stampa stesso deve essere convalidato in modo tale da garantire la coerenza da lotto a lotto e la tracciabilità durante tutto il processo , in base ai requisiti del sistema di qualità .
Si tratta di una classe di tecnologie di prototipazione rapida in cui la stampa 3D di livello medicale consente al team di ricerca e sviluppo di esplorare progetti precedentemente impossibili a costi inferiori e in tempi record. Il rigoroso controllo su materiali e processi garantisce che l'innovazione segua il percorso previsto dalla fase iniziale fino alla convalida clinica e alla registrazione del prodotto.
In che modo la produzione LS aiuta gli strumenti chirurgici minimamente invasivi a superare il collo di bottiglia tecnologico?
Il valore fondamentale della nostra attività di ricerca e sviluppo di dispositivi medici innovativi è legato ai servizi di prototipazione di dispositivi medici , che aiutano i clienti a superare i principali colli di bottiglia tecnologici nel lancio dei loro prodotti. Di seguito è riportato un tipico caso esemplificativo che dimostra l'applicazione dell'approccio di prototipazione medica di LS Manufacturing :
Sfida del cliente
Nel processo di sviluppo di un nuovo tipo di strumento chirurgico mininvasivo , un dispositivo per anastomosi intracavitaria, un'azienda innovativa ha dovuto affrontare enormi ostacoli durante i test sugli animali. Il meccanismo di trasmissione centrale presentava un ritardo significativo nel funzionamento e non era in grado di fornire ai chirurghi un controllo efficace e preciso dell'azione dell'anastomosi. Limitato dal processo di produzione tradizionale, non c'era più spazio per ulteriori ottimizzazioni a causa della sua complessa struttura di trasmissione interna.
Soluzione di produzione LS
Intervenendo, il nostro team di ingegneri ha immediatamente abbandonato il metodo di lavorazione tradizionale. Abbiamo impiegato la tecnologia di stampa 3D in acciaio inossidabile di grado medicale , realizzando un sistema di trasmissione monoblocco e monofase con un percorso meccanico superiore e un gioco estremamente ridotto. Questo non solo ha risolto il problema del ritardo; un ulteriore miglioramento è stato l'applicazione dell'elettrolucidatura a questa complessa cavità stampata monoblocco , conferendole una finitura superficiale di gran lunga superiore a quella standard e rispondendo perfettamente agli elevatissimi requisiti di sterilità e pulizia degli strumenti chirurgici.
Risultati e valore
Nei successivi test sugli animali, il prototipo appena realizzato ha funzionato perfettamente e la velocità di risposta operativa e la precisione dello strumento sono migliorate di circa il 60% , ottenendo grandi elogi da parte degli esperti clinici. Questa svolta tecnologica ha quindi anticipato direttamente i tempi di progetto complessivi del cliente di almeno 5 mesi e ha fatto risparmiare oltre 2 milioni di RMB in costi di ricerca e sviluppo sostenuti a causa di ripetuti tentativi ed errori e modifiche degli stampi.
Abbiamo applicato tecnologie avanzate, come la stampa 3D di livello medicale, per superare i comuni limiti strutturali, materiali e prestazionali degli strumenti chirurgici mininvasivi per i nostri clienti. Quelle che sembravano sfide tecniche impossibili si sono trasformate nella chiave della competitività del prodotto, garantendo ai nostri clienti preziose finestre di time-to-market ed enormi vantaggi in termini di costi.

Figura 4: Dosaggio di precisione nella fabbricazione di prototipi medici da parte di LS Manufacturing
Che tipo di documentazione tecnica richiede lo sviluppo di prototipi nei dispositivi medici?
Una documentazione tecnica completa è il fondamento per una registrazione di successo di un dispositivo medico. Serve principalmente a documentare in modo esaustivo il processo di controllo della progettazione e a fornire prove sulla sicurezza e l'efficacia del prodotto. Questa non costituirà solo una tabella di marcia per lo sviluppo interno, ma servirà anche come prova per le agenzie di regolamentazione dell'azienda della capacità di sviluppo sistematico e conforme. La documentazione tecnica includerà, a titolo esemplificativo ma non esaustivo, i seguenti documenti chiave:
- Documenti di input e output di progettazione: questo è l'inizio del sistema di documentazione: input di progettazione, che devono registrare in modo chiaro le esigenze degli utenti, le funzioni cliniche, gli indicatori di prestazione e gli standard normativi. Gli output di progettazione includeranno disegni di prodotto, specifiche tecniche, elenchi di componenti, ecc . Ogni input deve essere verificato per ottenere un output corrispondente.
- Certificazione dei materiali e documentazione di biocompatibilità: devono essere disponibili le certificazioni dei fornitori e i certificati dei materiali di tutti i materiali di grado medicale, unitamente alla valutazione della biocompatibilità o ai rapporti di prova pertinenti alle parti della USP Classe VI o della ISO 10993. Ciò è direttamente correlato alla determinazione della biocompatibilità del prodotto.
- Registri di convalida del processo di produzione: dimostrare che il processo di produzione del prototipo è coerente e controllabile per ogni processo critico coinvolto nella sua creazione, come i parametri di stampa 3D o i processi di sterilizzazione , tramite registri dettagliati dei parametri di processo, certificati di calibrazione delle apparecchiature e rapporti di ispezione del primo articolo.
In altre parole, significa che la creazione della documentazione tecnica come attività di base parallela alla prototipazione prepara a un avanzamento efficiente del progetto; non è un ripensamento. Un buon sistema di documentazione per il controllo della progettazione , come il "certificato di nascita" del prodotto, mostra chiaramente il percorso di progettazione dal concept al prototipo.
Come pianificare il percorso di richiesta di registrazione durante la fase di prototipazione?
Grazie a un solido lavoro di preparazione della domanda di registrazione , è possibile accelerare lo sviluppo di dispositivi medici e, in questo processo, ogni dato generato deve costituire un valido supporto per i futuri documenti di registrazione. In altre parole, è necessario pianificare sistematicamente i seguenti tre livelli:
Definire chiaramente i requisiti relativi alla prova di registrazione
La fase di input per la progettazione del prototipo richiede un'analisi approfondita dei requisiti normativi del mercato di riferimento. I principali parametri da verificare durante la revisione delle registrazioni, come indicatori di prestazione, biocompatibilità e sicurezza elettrica, vengono tradotti in parametri tecnici specifici che devono essere verificati dal prototipo. Ciò garantirebbe lo sviluppo di un prototipo conforme fin dall'inizio.
Trasformare i dati di convalida del prototipo in prove di registrazione
Il prototipo dovrà essere sottoposto a test funzionali, di durata e di usabilità conformi ai requisiti del sistema di qualità . Tutti i test dovranno essere eseguiti secondo un protocollo standard pre-approvato, che dovrà includere una registrazione completa dei dati grezzi e un report standardizzato.Si tratterà di dati altamente controllati che potranno poi essere presentati direttamente come prova fondamentale per la futura convalida del progetto, evitando così di dover ripetere i test.
Stabilire un sistema trasparente per la documentazione della cronologia della progettazione
Dovrebbe fornire una documentazione completa del processo che va dall'input progettuale alla revisione, alle modifiche e all'output. Questo sistema di documentazione, naturalmente strutturato nel processo di controllo della progettazione, può rivelarsi la prova migliore per dimostrare alle agenzie di regolamentazione che il processo di progettazione è rigoroso e controllato, il che può migliorare notevolmente l'efficienza e il tasso di successo delle revisioni di registrazione.
In altre parole, pianificare l'integrazione delle applicazioni di registrazione nella fase di prototipo è la leva migliore per accelerare lo sviluppo dei dispositivi medici , in quanto riduce notevolmente i costi elevati e i ritardi temporali sostenuti nelle fasi successive del progetto a causa dei dati di registrazione supplementari, migliorando al contempo la standardizzazione e il tasso di successo dell'intero processo di ricerca e sviluppo fin dall'inizio, gettando solide basi per un lancio rapido e stabile sul mercato dei prodotti.
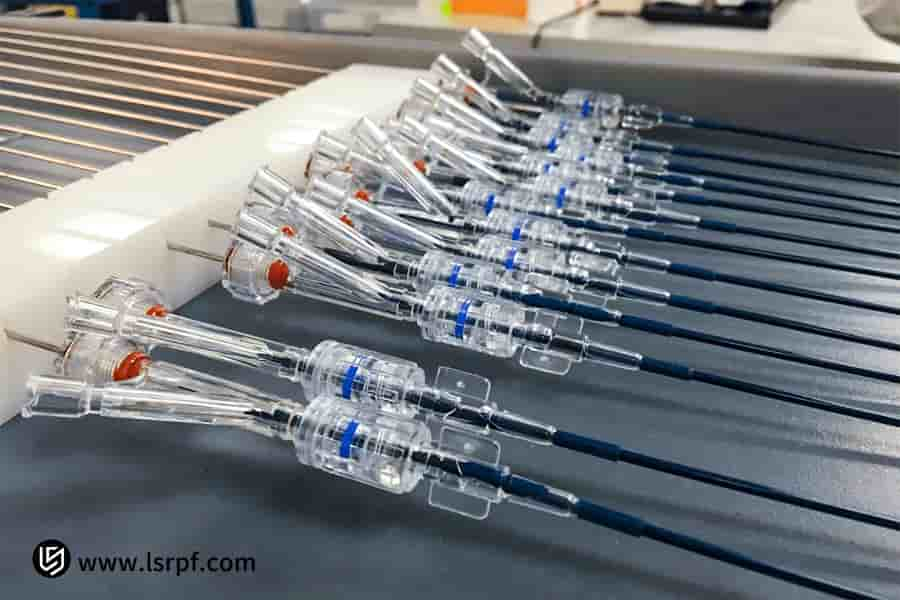
Figura 5: Prototipo a 360 gradi per la convalida funzionale da parte di LS Manufacturing
Domande frequenti
1. Quali requisiti specifici devono essere rispettati durante lo sviluppo di prototipi di dispositivi medici?
Inoltre, oltre alla funzionalità di base, è necessario affrontare in modo proattivo il rispetto degli standard specifici per i dispositivi medici. Applichiamo rigorosamente il sistema di qualità ISO 13485 per garantire che questi prototipi soddisfino i requisiti normativi in materia di biocompatibilità, tolleranza alla sterilizzazione, sicurezza elettrica e altri aspetti fin dalle prime fasi della loro registrazione.
2. Quanto tempo passa dall'ideazione alla realizzazione del primo prototipo funzionale?
Dipende dalla complessità del dispositivo. I dispositivi relativamente semplici richiedono circa 2-3 settimane, mentre quelli più complessi con trasmissioni di precisione e componenti elettronici richiedono 4-6 settimane . Disponiamo di un canale accelerato per rispondere in modo flessibile alle esigenze urgenti di ricerca e sviluppo e garantire pienamente la tempistica del progetto.
3. È possibile produrre piccoli lotti di dispositivi per la sperimentazione clinica?
Naturalmente, uno dei nostri vari servizi è la fabbricazione di piccoli lotti di dispositivi per studi clinici , da 10 a 100 unità . La produzione avviene secondo gli standard di produzione dei dispositivi medici e ogni unità sarà realizzata secondo i più elevati standard di prestazioni, qualità e coerenza richiesti per gli studi clinici.
4. Come si garantisce la biocompatibilità dei materiali dei prototipi?
Controlliamo i rischi fin dalla fonte attraverso la rigorosa selezione di materiali di grado medicale con certificazioni autorevoli come ISO 10993 o USP Classe VI. Insieme al prototipo, possiamo fornire la documentazione completa di certificazione dei materiali, fornendo prove concrete per la vostra valutazione di biocompatibilità.
5. Come proteggete la nostra proprietà intellettuale durante il processo di prototipazione?
La sicurezza delle informazioni è la nostra linfa vitale. Ogni progetto inizia con un accordo di riservatezza legalmente vincolante e, internamente, applichiamo un rigoroso sistema di gestione della gerarchia dei dati e di controllo degli accessi.Se richiesto dal cliente, possono essere installati anche firewall fisici e informatici.
6. Che tipo di prototipi di dispositivi medici supportate?
I servizi offerti dalla nostra azienda spaziano dai dispositivi attivi, come le apparecchiature diagnostiche, a quelli passivi, inclusi strumenti chirurgici, impianti e dispositivi non impiantabili . LS Manufacturing vanta una profonda conoscenza delle normative e dei processi associati ai vari prodotti.
7. Come rendere disponibili i dati del prototipo per l'utilizzo nelle domande di registrazione successiva?
Oltre ai prototipi, forniamo un pacchetto completo di prove di qualità, che include registri di produzione dettagliati, rapporti di ispezione dei processi e dati dei test prestazionali . Tutti i dati sono generati secondo le specifiche e possono essere direttamente utilizzati come materiale di verifica della progettazione a supporto delle domande di registrazione.
8. Come avviare un progetto di prototipo di dispositivo medico?
Il processo per iniziare è piuttosto semplice: basta compilare alcuni schizzi concettuali iniziali o requisiti tecnici e noi faremo in modo che un ingegnere senior ti contatti entro un giorno lavorativo per discutere in dettaglio le soluzioni tecniche e fornirti una valutazione iniziale del progetto e un preventivo.
Riepilogo
I prototipi di dispositivi medici sono molto più di una semplice realizzazione tecnica: sono il fondamento della gestione del rischio, della conformità normativa e del successo commerciale. Trovare il partner giusto per la prototipazione getta solide basi per l'intero ciclo di vita del prodotto.
Pertanto, se desiderate accelerare la ricerca e sviluppo riducendo al contempo i rischi di registrazione, contattate oggi stesso i nostri esperti in dispositivi medici per una "Soluzione di prototipazione orientata alla registrazione" per il vostro progetto! Affidateci la nostra esperienza professionale nella produzione di dispositivi medici per proteggere il vostro percorso di innovazione.
📞Telefono: +86 185 6675 9667
📧Email: info@longshengmfg.com
🌐Sito web: https://lsrpf.com/
Disclaimer
Il contenuto di questa pagina è puramente informativo. LS Manufacturing non rilascia alcuna dichiarazione o garanzia, espressa o implicita, in merito all'accuratezza, completezza o validità delle informazioni. Non si deve dedurre che fornitori o produttori terzi forniscano parametri prestazionali, tolleranze geometriche, caratteristiche di progettazione specifiche, qualità e tipologia dei materiali o processi tramite la rete LS Manufacturing. L'acquirente è l'unico responsabile di queste informazioni. Per preventivi sui componenti, si prega di specificare i requisiti esatti per tali componenti. Per ulteriori informazioni, contattateci .
Team di produzione LS
LS Manufacturing è un'azienda leader del settore, specializzata in soluzioni di produzione personalizzate. Con oltre 20 anni di esperienza al servizio di oltre 5.000 clienti, ci concentriamo su lavorazioni CNC ad alta precisione, lavorazione della lamiera , stampa 3D , stampaggio a iniezione , stampaggio di metalli e altri servizi di produzione completi.
Il nostro stabilimento vanta oltre 100 centri di lavorazione a cinque assi all'avanguardia ed è certificato ISO 9001:2015.Forniamo soluzioni di produzione rapide, efficienti e di alta qualità a clienti in oltre 150 paesi e regioni in tutto il mondo. Che si tratti di produzione in piccoli lotti o di personalizzazione di massa, possiamo soddisfare le vostre esigenze entro 24 ore. Scegliere LS Manufacturing significa scegliere efficienza, qualità e professionalità.
Per maggiori informazioni, visita il nostro sito web: www.lsrpf.com .